苏州大学钟志远、王慎强教授《Adv. Mater》:基于仿生自噬小体的纳米疫苗增强抗肿瘤免疫治疗
时间:2024-09-09 18:05:05 热度:37.1℃ 作者:网络
个性化肿瘤疫苗是肿瘤免疫治疗领域的一个重要研究方向,通过将肿瘤特异性抗原与免疫佐剂共同递送至抗原呈递细胞,以诱发特异性的抗肿瘤免疫反应,最终消除肿瘤。然而,由于肿瘤抗原的免疫原性较弱,传统基于肿瘤细胞裂解物的疫苗效果有限。自噬是在所有真核生物中严格调控和应激诱导的一种分解代谢通路,在抗原呈递和激发宿主细胞免疫方面发挥着重要作用。自噬小体(Autophagosomes)作为肿瘤新抗原的重要来源,具有较强的免疫原性,但其在个性化肿瘤疫苗中的应用受限于淋巴结靶向性能和抗原递呈细胞的吞噬效果不足。

针对上述难题,苏州大学钟志远、王慎强教授团队开发了一种仿生自噬小体纳米疫苗(BAPs),用于增强肿瘤特异性免疫反应。通过提取自噬小体,并将其衍生的抗原和两种佐剂(TLR-9激动剂CpG和STING激动剂ADU-S100)整合到自组装的纳米囊泡中,形成BAPs纳米疫苗。在MC-38结肠癌和4T1乳腺癌模型中,评估了BAPs纳米疫苗的抗肿瘤效果。该研究于近日以“A Biomimetic Autophagosomes-Based Nanovaccine Boosts Anticancer Immunity”为题在线发表于《Advanced Materials》期刊。
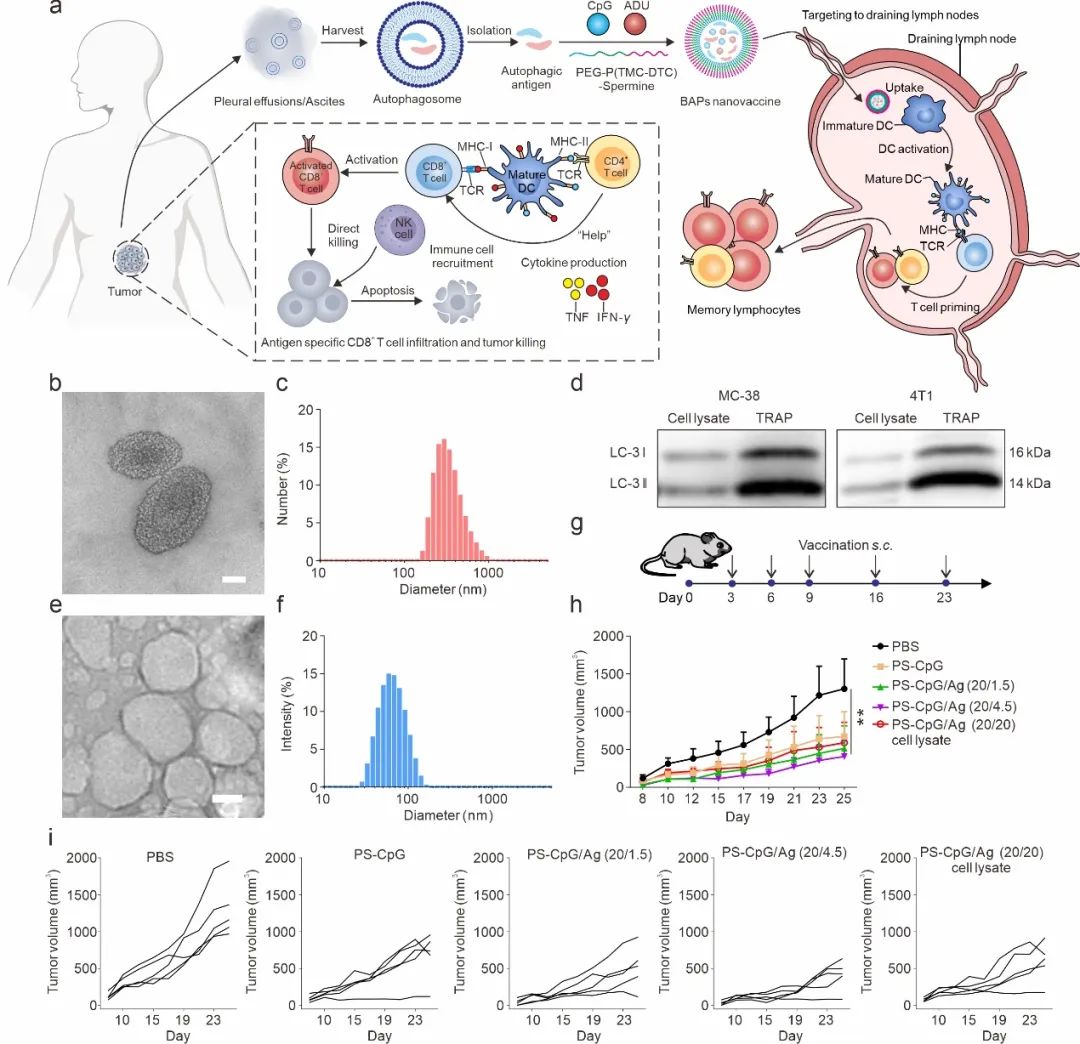
图1. 基于仿生自噬小体(BAP)纳米疫苗的设计和免疫应答示意图
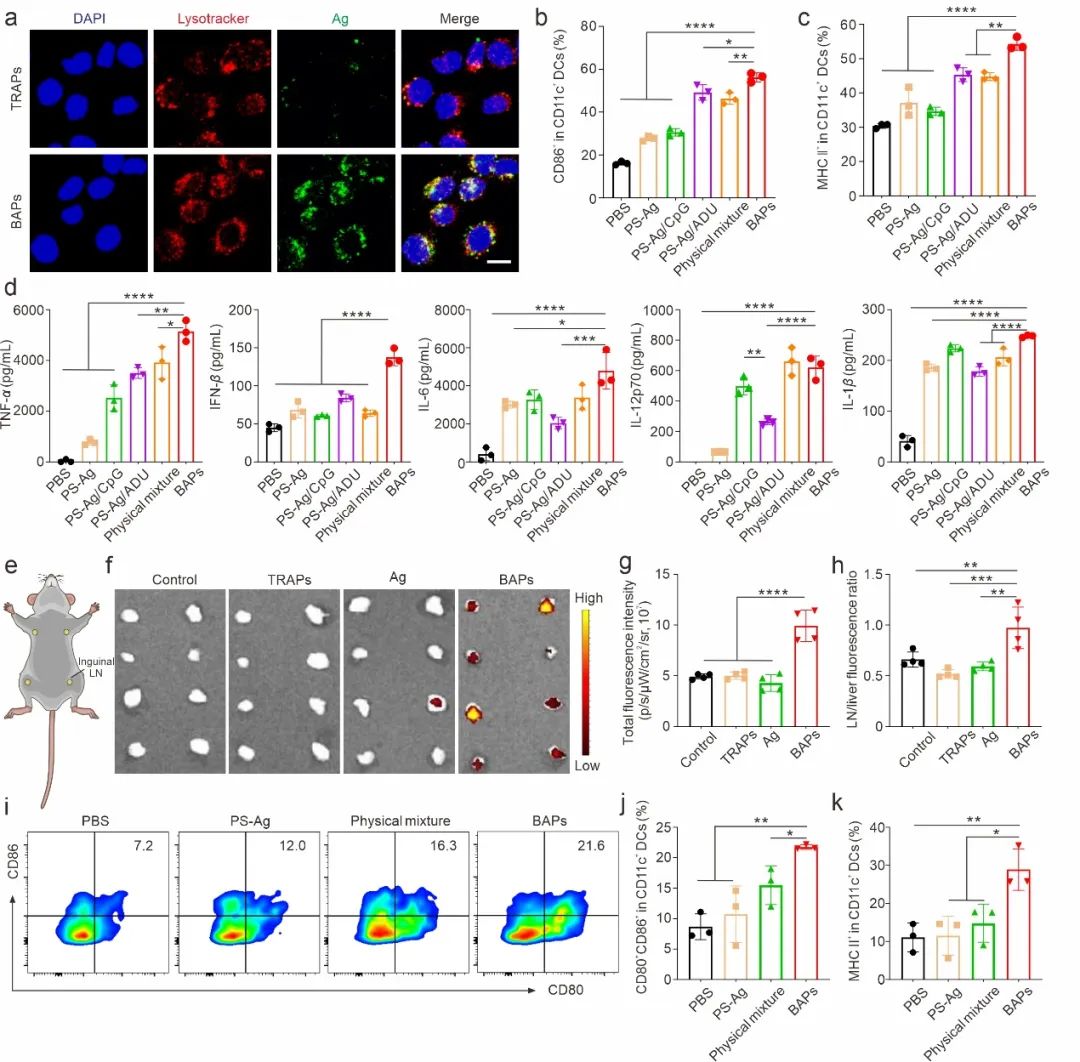
图2. BAPs纳米疫苗将抗原(Ag)和佐剂靶向递送到淋巴结中,并诱导DC成熟
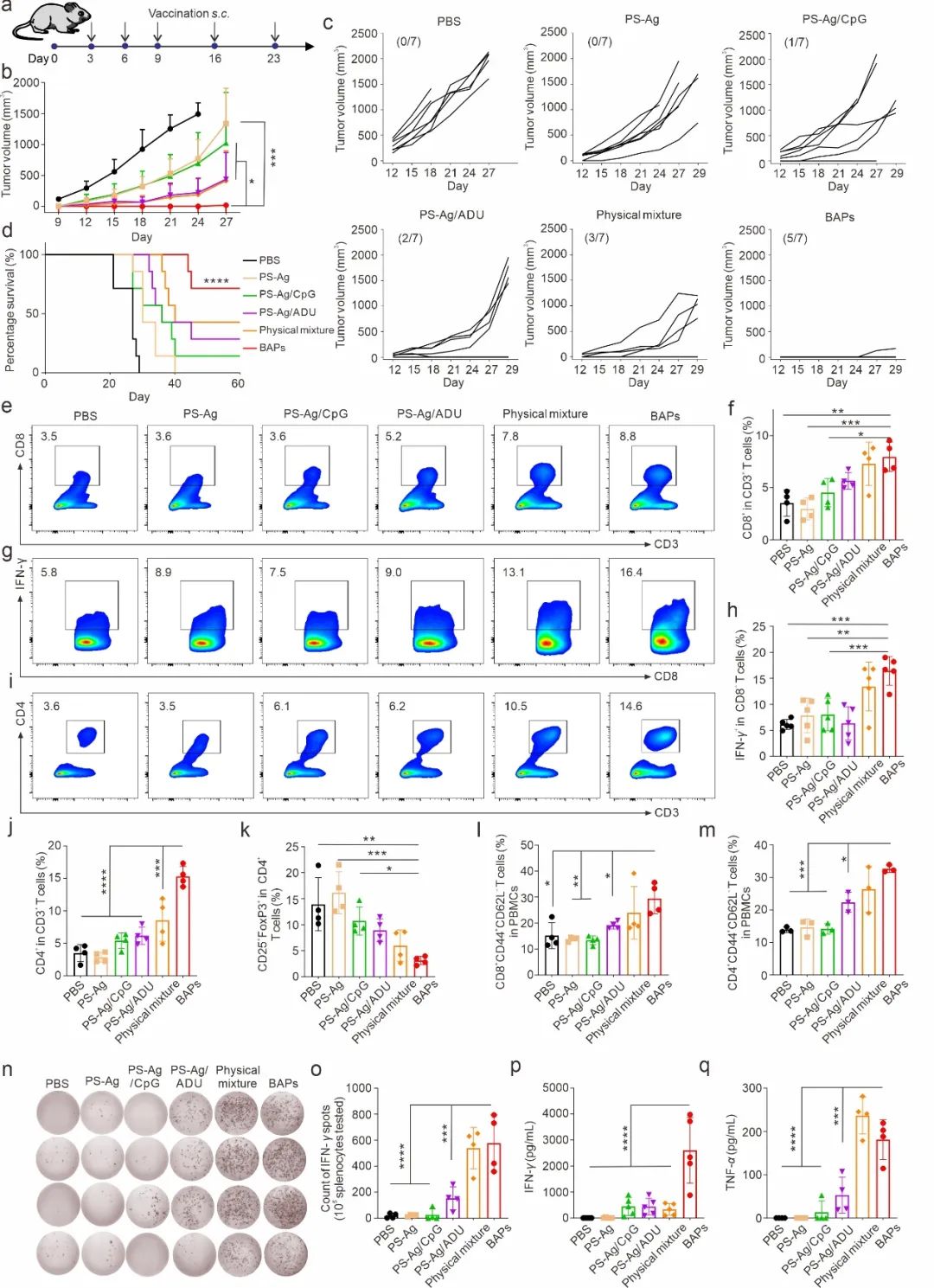
图3. BAPs 有效抑制肿瘤生长并提高荷瘤小鼠的存活率
BAPs纳米疫苗通过有效递送抗原和佐剂到淋巴结,显著促进了抗原递呈细胞(DCs)的成熟,并诱导了广泛的T细胞反应,特别是CD8+毒性T淋巴细胞(CTLs)的浸润,显著抑制了肿瘤生长。
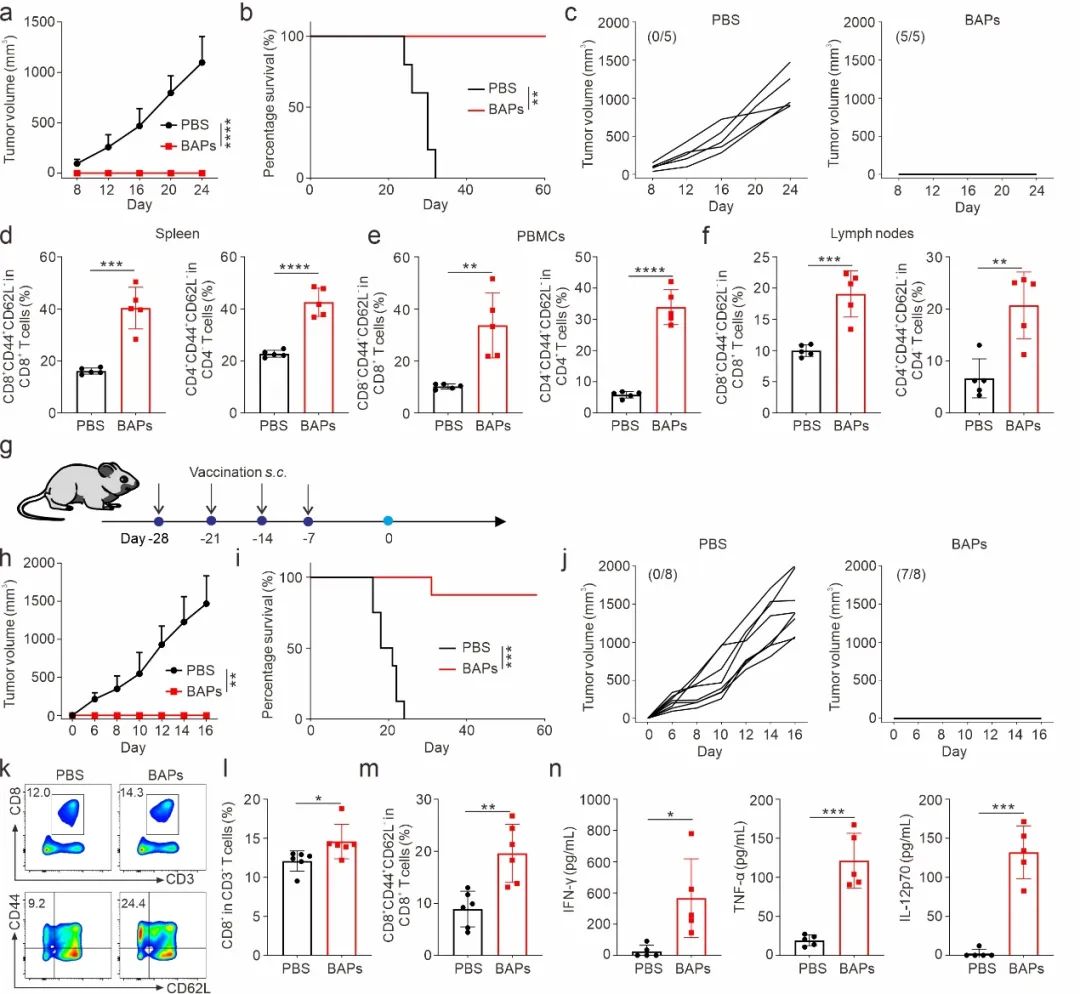
图4. BAPs 纳米疫苗可防止肿瘤复发并预防肿瘤发生
BAPs激活免疫不仅有效清除肿瘤,还能建立持久的免疫记忆,100%的小鼠在肿瘤再挑战实验中表现出完全的肿瘤清除能力,并在预防实验中显示出强大的抗肿瘤发生能力。
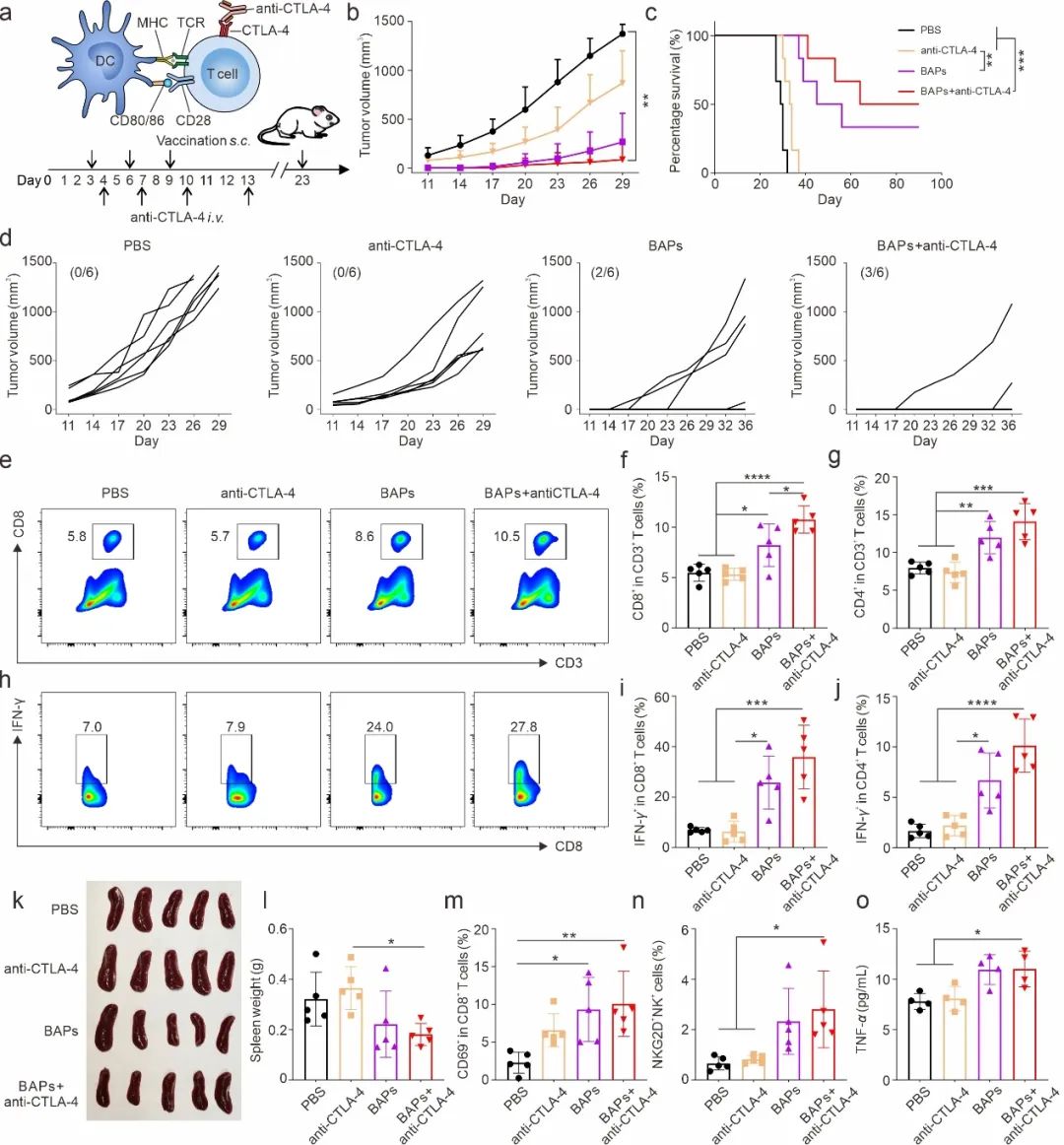
图5. BAPs与ICB疗法协同治疗4T1肿瘤
在4T1乳腺癌“冷肿瘤”模型中,BAPs与免疫检查点抑制剂(ICB)联合治疗显著提高了抗肿瘤效果,延长了小鼠的生存期。
总结:该研究展示了仿生自噬小体纳米疫苗在增强抗肿瘤免疫反应中的巨大潜力,为个性化肿瘤疫苗的开发提供了新的策略。通过整合自噬小体衍生的高免疫原性抗原和靶向淋巴结的佐剂,BAPs纳米疫苗展现出优异的抗肿瘤效果,尤其在难治性肿瘤的治疗中具有重要应用前景。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202409590


