易庆团队《自然·通讯》:发现LILRB1为多发性骨髓瘤治疗的新靶点
时间:2024-07-17 17:01:37 热度:37.1℃ 作者:网络
多发性骨髓瘤(multiple myeloma, MM)是仅次于非霍奇金淋巴瘤的第二大常见血液系统恶性肿瘤,其特点是骨髓中浆细胞的恶性增殖。近几十年来,随着骨髓移植及蛋白酶体抑制剂等治疗手段的不断发展,MM病人的存活率有显著提高,但MM依然是不可治愈的疾病。2020年的统计数据显示,MM每年在全球范围内导致约10万人的死亡1。部分MM患者的病情进展迅速,存活时间短。而导致MM发生高危进展的机制尚未明确,需要进一步寻找在MM恶性进展中起到关键作用的基因及相关机制,以便开发新的MM治疗靶点。
2024年7月9日,康奈尔医学院&休斯顿卫理公会研究所的易庆团队在Nature communications期刊上发表题为Leukocyte immunoglobulin-like receptor B1 (LILRB1) protects human multiple myeloma cells from ferroptosis by maintaining cholesterol homeostasis的研究,为骨髓瘤的治疗发掘了全新靶点。该团队发现在MM细胞中,膜蛋白LILRB1通过协助MM细胞摄取低密度脂蛋白(LDL),维持细胞内胆固醇合成通路中具有抗氧化作用的代谢物角鲨烯(squalene)的含量,从而保护MM细胞不发生铁死亡,促进多发性骨髓瘤的恶性进展。
为了寻找MM潜在的治疗靶点,研究人员首先对比了预后良好(从诊断起存活时间≥4年)和预后不良(从诊断起存活时间<2年)的MM患者中MM细胞的基因表达谱(GEP),找到了超过7000个表达有显著差异的基因(P<0.05)。在预后不良的相关基因里,LILRB1是表达差异最为显著的基因之一。LILRB1在多种免疫细胞中介导了免疫抑制反应,但在肿瘤生物学中的作用及相关机制尚不明确。进一步的分析发现LILRB1在MM患者中的表达高于正常人体内浆细胞的表达,在MM Ⅲ期患者中的表达高于Ⅰ期患者,在复发性MM患者中的表达高于非复发性MM患者。这些结果都显示LILRB1的高表达与MM的恶性程度及病人的预后不良密切相关,是值得进一步研究的潜在治疗靶点。
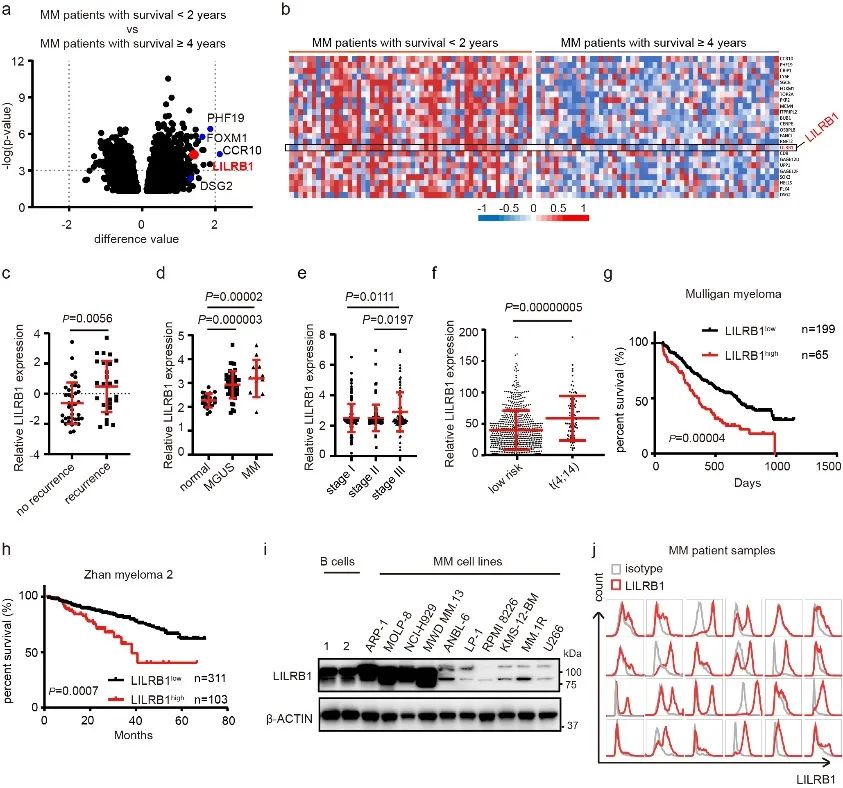
图一.LILRB1的高表达与多发性骨髓瘤病人的恶性进展和预后不良密切相关
随后,研究人员对LILRB1在MM中的作用进行了实验验证。实验结果发现,敲除(knock down,KD)LILRB1在体外并不引起明显的细胞凋亡,而在免疫缺陷小鼠体内能显著抑制肿瘤细胞的增长。同时,过表达LILRB1能促进MM细胞在免疫缺陷小鼠体内的增长。以上结果说明LILRB1能在肿瘤微环境的压力中保护多发性骨髓瘤细胞,并促进其存活和扩增。为进一步探索微环境中哪一类因素抑制了MM细胞的增殖,LILRB1又是通过影响哪些信号通路保护了MM细胞,研究人员将小鼠骨髓中的LILRB1-KD细胞和对照组CTR-KD细胞进行了RNAseq分析,发现敲除LILRB1会引起氧化应激的增强、脂质稳态的降低和LDL/胆固醇的减少,并且在LILRB1-KD细胞中铁死亡相关通路被激活。铁死亡是一种铁离子依赖的,由于脂质过氧化物堆积导致的细胞死亡2。进一步的实验表明,LILRB1-KD 细胞对铁死亡相关压力更加敏感;铁死亡抑制剂能够逆转LILRB1的敲除在体外和体内引起的细胞死亡。此外,LILRB1表达量低的MM原代细胞对铁死亡诱导剂更加敏感。这些实验结果说明,LILRB1能在肿瘤微环境中保护MM细胞,抑制MM细胞发生由脂质过氧化引起的铁死亡。
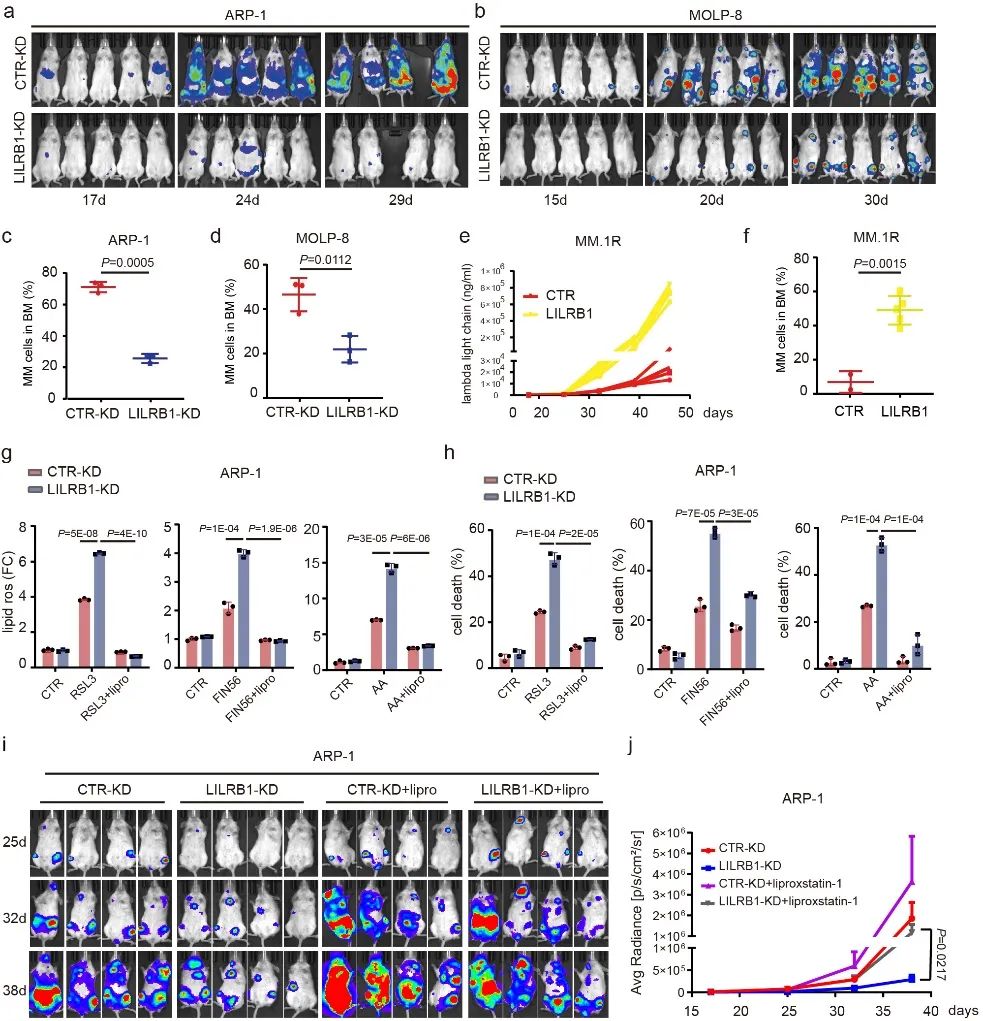
图二.LILRB1的敲除在体内和体外促进骨髓瘤细胞发生铁死亡
那么LILRB1是通过怎样的作用机制发挥了对MM细胞的保护作用呢?鉴于LILRB1已知的功能与铁死亡没有明确关联,研究人员推测:LILRB1会与其他蛋白结合发挥尚未被报道的功能。通过质谱分析,研究人员鉴定到了约300个可能与LILRB1结合的蛋白,结合RNAseq结果中脂质稳态和胆固醇相关通路的变化,将目光聚焦于与这些通路相关的蛋白low-density lipoprotein receptor adaptor protein 1 (LDLRAP1)。进一步的实验结果证明了LILRB1能够同时与low-density lipoprotein receptor(LDLR)和LDLRAP1结合,并能促进MM细胞对LDL的摄取。敲除LILRB1会导致LDLR与LDLRAP1结合的减弱,抑制MM细胞对LDL的摄取,扰乱MM细胞中的胆固醇代谢;同时,为了维持细胞中胆固醇的含量,LILRB1-KD MM细胞的反馈调节作用会激活胆固醇合成途径,引起胆固醇合成路径中的限速酶SQLE表达的上升;SQLE的底物是具有抗氧化作用的代谢物squalene,SQLE的升高导致MM细胞中squalene的含量下降,使MM细胞更容易发生铁死亡。
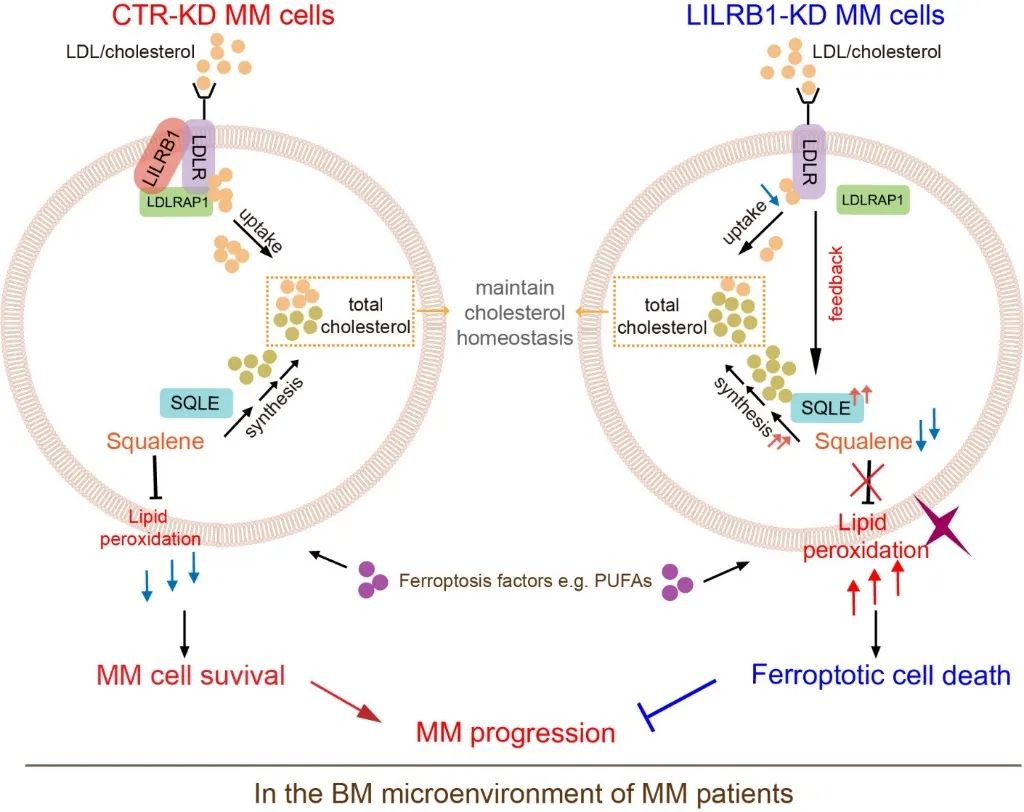
图三.LILRB1在骨髓瘤细胞中的功能及相关机制
综上,这项研究通过对MM病人临床数据的分析找到了在MM进展中有关键作用的蛋白LILRB1,并且发现了LILRB1在促进胆固醇摄取和抑制铁死亡中的全新功能及相关作用机制。LILRB1是在免疫细胞中被熟知的免疫抑制受体蛋白,但其在肿瘤细胞中所发挥的功能和相关机制未有深入研究和报道。易庆团队的研究发现了LILRB1能促进LDL/胆固醇的摄取、维持胆固醇稳态并抑制MM细胞发生铁死亡, 为LILRB1作为MM患者的全新治疗靶点提供了重要支撑数据,为MM患者治疗策略的进一步研究提供了新思路。
美国康奈尔医学院&休斯顿卫理公会研究所的鲜苗博士和王强博士为该论文的第一作者,易庆教授为该论文的通讯作者。
参考文献:
1、Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin 70, 7-30 (2020).
2、Dixon SJ, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell 149, 1060-1072 (2012).
原文链接:
https://www.nature.com/articles/s41467-024-50073-x


