临床实例,早期高风险乳腺癌放疗后应用ctDNA MRD监测效果如何?
时间:2024-06-18 18:00:37 热度:37.1℃ 作者:网络
早期乳腺癌患者的标准检测通常不使用系统性监测或影像学检查,因为患者接受了针对性治疗。然而,使用循环肿瘤DNA(ctDNA)检测可能为尽早发现癌症复发提供机会,尤其是对于高风险或侵袭性乳腺癌患者。本文介绍了两例早期三阴性乳腺癌(TNBC)病例,其中ctDNA筛查有助于在影像学发现之前检出复发。因此,治疗得以更早开始。这些病例强调了将ctDNA监测整合到肿瘤放疗临床实践中以检测乳腺癌复发的潜在价值,以及将其用于常规临床实践如何为患者带来获益。本文还对当前有关ctDNA检测的文献进行了回顾,包括其优点和局限性。虽然目前没有足够的数据支持对所有患者进行常规ctDNA筛查,但研究人员推测特定患者群体可能会从这种创新诊断工具中取得最大获益。
背 景
检测乳腺癌复发(尤其是在早期阶段)的最佳方法仍不确定。目前,早期乳腺癌幸存者的标准检测包括常规病史采集、体格检查和仅针对乳房的监测成像。根据美国国家综合癌症网络指南(NCCN,2023),目前不建议在针对性治疗后使用实验室或影像学进行系统性监测,除非有临床指征提示疾病复发。值得注意的是,一旦发生转移,乳腺癌的预后就会变差,治疗主要侧重于疾病控制而不是治愈。
大约 30% 的乳腺癌幸存者和超过 40% 的I-III期三阴性乳腺癌(TNBC)患者在接受标准治疗后会出现复发,因此这一高危人群将有望从先进的复发早期检测方法中获益。循环肿瘤DNA(ctDNA)血液检测是此项工作的理想候选者,它提供了一种非侵入性、灵敏的生物标志物,用于检测和监测各种癌症患者的微小残留病灶(MRD)。多项研究已证明MRD检测在预测复发风险、指导治疗决策和潜在改善癌症结果方面的有效性。在最近一项针对I期结肠癌患者的研究中,发现ctDNA管理在 2 年无复发生存率方面与标准监测方法一样有益,并且ctDNA检测可减少辅助化疗的使用。
尽管使用ctDNA检测进行MRD监测是一项不断发展的技术,需要进一步研究才能确定其作为监测工具的价值,但该技术已经证明,它可以比几种癌症类型的传统监测方法更早地检测到疾病的存在。在一项以ctDNA为指导的尿路上皮癌治疗研究中,ctDNA检测呈阳性的患者从全身治疗中获得了显著益处,而检测呈阴性的患者则没有。另一项关于膀胱切除术后膀胱癌的研究发现,ctDNA分析具有 100% 的特异性和 98% 的敏感性。
肿瘤科治疗许多不同群体的患者,包括初次出现寡转移、异时性转移、同步性转移的患者以及其他需要个性化治疗的重要病例。在一项针对 1800 名患者的研究中,50% 的骨转移是由转移性乳腺癌引起的。患有寡转移性骨转移性疾病的乳腺癌患者的生存率比患有更广泛疾病的患者更高。目前,可能获益于针对寡转移性复发放疗(例如使用立体定向放疗)的患者特点是肿瘤负荷低、无病间隔期长以及能够所有疾病部位均可消融。对无症状骨转移进行预防性放疗可以预防不良骨骼事件并提高总生存率。ctDNA检测有可能提高这些转移灶的识别率和治疗率。由于血脑屏障的存在,脑转移瘤通常很难通过系统性化疗治疗,但可以通过放疗进行早期治疗。随着这些发展,肿瘤学领域有更多机会协助患者监测和治疗,本系列病例强调了在早期高风险乳腺癌患者接受针对性治疗后使用ctDNA检测进行MRD监测的价值。
病例1
患者女,55 岁,左腋窝有一个肿块,超声检查显示肿块大小为 4.6 cm。活检显示转移性乳腺导管癌,ER阳性(5%),PR和HER-e/neu阴性。淋巴结阳性明显,因此患者于 2021 年 8 月 26 日进行了PET-CT扫描。初步分期为2B期、T2N2BM0 3 级左侧乳腺癌,扩散至左腋窝淋巴结和一个胸肌下淋巴结。患者在 2.5 个月内完成了新辅助紫杉醇治疗,于 2022 年 2 月 1 日结束。患者对化疗的耐受性良好,继续接受治疗,并注意到癌症大小有所缩小,尤其是左腋窝。1 个月后,患者选择接受双侧乳房切除术和轴向淋巴结清扫术(ALND)。右侧乳房为良性,左侧乳房为 2 级导管原位癌。随后对左胸壁、锁骨上淋巴结、锁骨下淋巴结、左腋窝和内乳淋巴结进行了术后放疗。该治疗已完成且耐受性良好,患者反应良好。由于ER阳性率仅为 5%,因此未进行辅助激素治疗。尽管PET-CT扫描未发现疾病进展,但患者报告存在慢性骨痛(归因于关节炎)。在患者随访期间,ctDNA检测结果为阳性,为 136.72 MTM/mL,表明之前的PET扫描未能发现疾病残留。后续的PET-CT扫描证实了这一点:肝左前叶第 2 和 4 段出现新发转移;肝右后叶第 6 段出现新发转移;出现新的肝门淋巴结;T9椎体右侧出现新发转移;左侧下骶骨新发溶骨性转移;L1椎体左侧新发溶骨性转移;右侧股骨近端干骺端转移。当时,患者前来复查PET-CT结果并制定姑息治疗计划,患者背部疼痛评分为 5/10。
患者开始对转移瘤进行姑息性放疗,并始使用德曲妥珠单抗,此前肝活检证实了ypTIS N2A,即复发性转移性导管癌,此外ER/PR均小于 1%。HER-2/neu经IHC检测呈2+阳性,但FISH呈阴性。患者完成了 2 个周期的德曲妥珠单抗治疗,效果良好,肝酶情况得到改善(AST从 563 降至 416,ALT从 186 降至 103,碱性磷酸酶从 538 降至 416)。然而,由于患者出现恶心和呕吐,第三个周期被推迟,从 2022 年 11 月 16 日推迟到 2022 年 12 月 5 日,并最终决定推迟进一步治疗(图1、图3)。
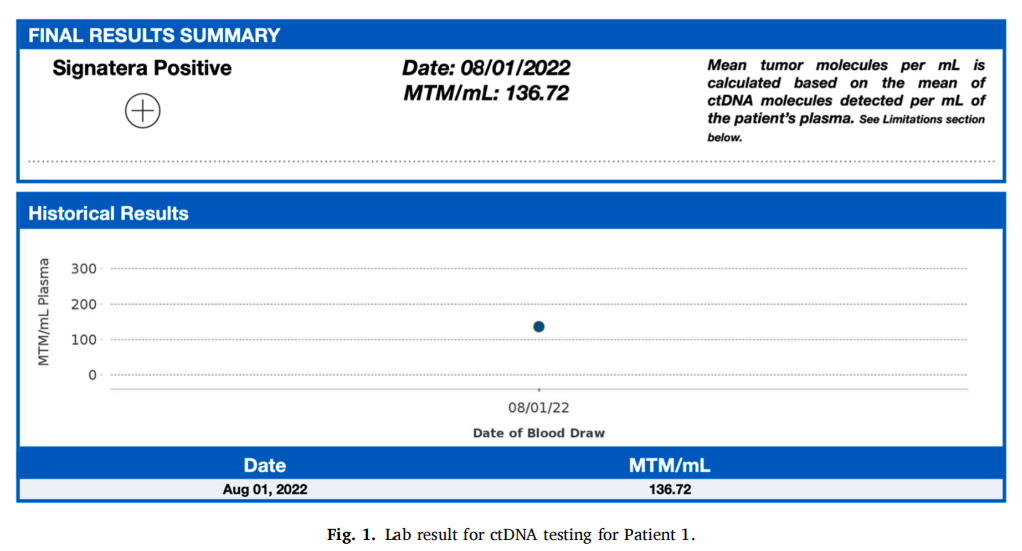
▲图1 病例1的ctDNA实验室结果
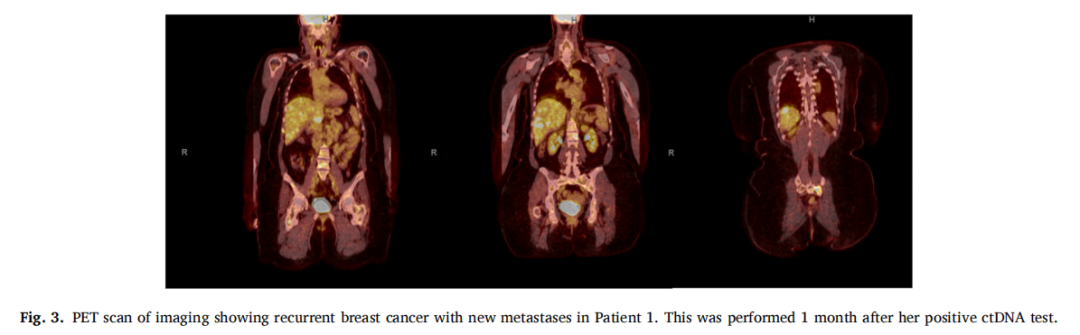
▲图3 病例1的PET-CT影像显示乳腺癌复发并出现新发转移
病例2
患者女,70 岁,因左乳房疼痛于 20 年 1 月 30 日接受双侧乳房诊断性X光检测,结果显示左腋窝处有一个边界不清的低回声肿块,内有钙化,淋巴结皮质增厚约 5 mm。20 年 2 月 3 日在超声引导下进行穿刺活检,病理结果显示浸润性导管癌,高级别,有可疑淋巴血管侵犯,高级别DCIS,实性,中央局部坏死,有微钙化;ER/PR/HER-2(-)。左腋窝活检结果符合乳腺转移性癌,并有淋巴结外扩散。
2020 年 2 月 11 日双侧MRI检查和 2020 年 2 月 12 日PET-CT检查结果与活检结果一致,证实为左侧TNBC伴左腋窝转移。没有远端转移的证据。2020 年 3 月 12 日至 2020 年 4 月 23 日,患者接受了新辅助剂量密集AC(多柔比星+多磷酰胺)治疗,除严重中性粒细胞减少症外,耐受性良好。2020 年 4 月 1 日进行了基因检测,未发现致病突变。2020 年 5 月 6 日进行了双侧乳房MRI,结果显示活检肿块梭小,左腋窝淋巴结也缩小了。增强CT发现左乳房出现新的不规则肿块,可能为恶性病灶。随后于 2020 年 5 月 7 日至 2020 年 6 月 23 日接受了紫杉醇治疗。2020 年 6 月 1 日尝试对新肿块进行MRI引导下活检,但由于无法识别取消。20 年 8 月 3 日,患者接受了左乳肿瘤切除术和腋窝淋巴结清扫术,检测结果显示残留的浸润性导管癌,6 mm,3 级,阴性边缘,有微钙化和淋巴结外扩散,1/7 腋窝淋巴结呈阳性。20 年 9 月 10 日至 20 年 10 月 26 日,患者接受了左乳和区域淋巴结的IGRT(图像引导放疗)治疗。
2021 年 1 月 11 日的随访MRI显示右乳房前部有一处组织增强,超声检查显示存在可疑异常。2021 年 2 月 1 日对右乳房进行了活检,显示非典型小叶增生,2021 年 6 月 24 日的第二次活检再次证实了这一点。2021 年 8 月 16 日的MRI显示左乳房出现新的局部增强,建议进行活检。2021 年 9 月 29 日进行了活检,结果显示为高级别DCIS。随后,患者于 2021 年 12 月 8 日进行了双侧乳房切除术,乳房切除术后所有切缘均为阴性。每 3 个月进行一次ctDNA检测以监测复发情况。乳房切除术后 19 个月的ctDNA检测呈阳性,为 0.06 MTM/mL,在 23 个月时增至 9.42 MTM/mL,最后在 25 个月时增至 18.90 MTM/mL。患者没有症状,这种上升趋势促使她进行PET-CT检查,结果发现了新的肺转移和肝转移。活检证实为复发性TNBC,患者于 2022 年 11 月开始使用戈沙妥珠单抗治疗。2 个月后,患者ctDNA降至 0.16 MTM/mL,2023 年 2 月 6 日的最新PET-CT显示患者病情稳定或恶化(图2)。
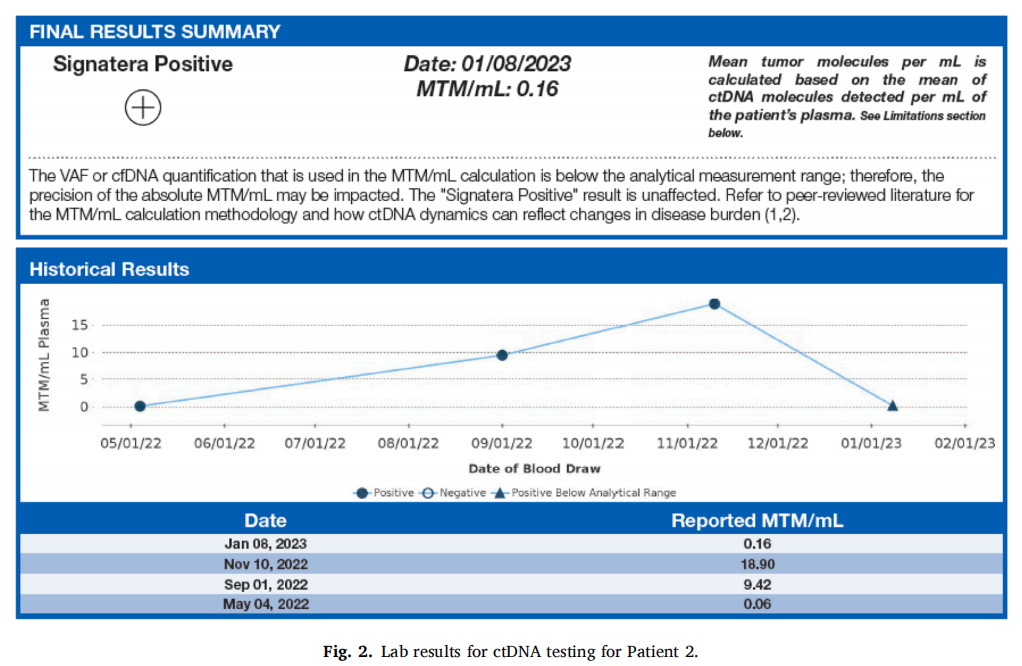
▲图2 病例2的ctDNA实验室结果
讨 论
文献中广泛讨论了乳腺癌治疗中强化监测对改善患者预后的好处。目前的筛查主要涉及局部复发,即每年进行乳房X光以检测局部复发。如前所述,NCCN指南不建议在针对性治疗后通过生物标志物或影像学对乳腺癌患者进行系统性筛查(NCCN,2023年)。这是可以理解的,因为传统的血液生物标志物(如CA15-3 和 CA27.29)的敏感性和特异性较低,可能导致假阳性结果、过度治疗和患者损伤。考虑到这些局限性,ctDNA在监测乳腺癌患者早期复发方面已显示出临床有效性。
Medford等人进行的一项回顾性II期试验表明,在雌激素受体阳性(ER+)和HER2-乳腺癌中,ctDNA阳性比临床和影像学复发早 7 个多月。Shaw等人进行的另一项研究报告称,在 156 名乳腺癌患者中使用ctDNA监测,有 34 名检测出复发,灵敏度为 88%,与未检测到ctDNA的患者相比,可检测到ctDNA的患者的无复发生存期和总生存期更差。有趣的是,ctDNA检测比影像学复发检测的中位提前时间为 10 个月,激素受体阳性(HR+)患者的中位提前时间为 13 个月,TNBC患者为 8-9 个月。这些发现表明,与TNBC等更具侵袭性的疾病相比,较为惰性的疾病具有更长的前置时间。此外,结果突出了各种癌症亚型的差异,TNBC患者需要更长时间监测,HR+需要患者更早、更频繁地进行监测。此外,在一项研究生物标志物的回顾性研究中,Chin等人证明了ctDNA检测在检测ER+/HER2-转移性乳腺癌方面的有效性。该研究确定了 11 名肿瘤低于RECIST影像学检测阈值的患者,其中 73% 为ctDNA阳性。全身影像学对患者结果几乎没有显著影响,乳腺癌患者治疗后进行影像学密集型随访与任何生存获益无关。此外,由于解读影像学图像或进行组织活检的复杂性,检测骨转移也带来了挑战。然而,Chin等人发现 ctDNA 检测成功识别出 67% 的骨转移乳腺癌患者。这些发现强调了ctDNA作为成像方式和标准诊断方法的补充工具在检测转移性乳腺癌方面的潜力,这是一种有望超越历史方法的替代方法。
尽管ctDNA监测结果令人鼓舞,但仍需要更多数据来确定将ctDNA筛查纳入临床实践的最佳方法。ctDNA检测的一次阴性结果并不能保证患者不会复发,需要进行连续检测才能全面监测患者的癌症进展。虽然多次抽血是不可避免的,但了解这些癌症的动力学可以区分临床实践并为未来试验的设计提供参考。
美国医疗保险已将ctDNA检测的覆盖范围扩大到多种实体瘤、侵袭性膀胱癌和泛肿瘤免疫疗法,从而减轻了患者的经济负担。此外,2 月 16 日,美国医疗保险将覆盖范围扩大到IIb期或更晚期乳腺癌患者,凸显了ctDNA检测作为复发性患者早期检测工具的潜力。
总之,ctDNA监测在高风险乳腺癌患者中显示出在临床复发之前检测分子复发方面展现除巨大的前景,并有可能改善患者的预后。然而,需要进一步研究以确定将ctDNA筛查纳入临床实践的最佳方法,并且应使用多次抽血的结果来监测癌症进展。随着医疗保险参与承担ctDNA 检测费用,这项有前途的技术可能很快在复发性患者得到更广泛地使用。在肿瘤学实践中使用ctDNA检测可能会增加转移的识别、协调治疗和改善结果。然而,需要进一步研究来确定这项技术的全部潜力和最佳应用方式。随着精准医学的发展,ctDNA检测可能成为乳腺癌幸存者治疗的有力工具。
患者感想
本病例系列中的两名患者都清楚地认识到自己疾病的高风险和可能出现的不良后果。第一位患者对疾病复发的早期发现表示感谢,并表示“这让我有时间处理好自己的事情”。由于患者需要照顾中风丈夫,还有一个仍需抚养的未成年女儿,早期发现疾病对患者安排亲人的照料至关重要。此外,提前检出还为她提供了必要的时间来规划家庭未来,以及向其他亲属传递消息。
第二位患者将ctDNA检测描述为一种“神迹”。在进行乳房肿瘤切除术和双乳切除术后,患者以为已经治愈了癌症。在随访期间,患者的血液检查和影像学检查显示身体正常,没有癌症。如果不是ctDNA结果的不断增加,患者不会认真对待随访,因为她认为自己已经痊愈了。此外,ctDNA在及早发现癌症复发的同时,也为患者了解自身疾病状况带来了帮助。患者表示:“我不是医生,对我来说,我整个人都被这一切震撼了,我很感激能有这样的技术,我可以实时看到疾病对我的影响。基于它的结果,我进行PET-CT扫描,并针对我的疾病采取了相应治疗。”
结 论
总之,本文凸显了ctDNA检测在已完成针对性治疗的乳腺癌患者中检测疾病复发的潜力,并表明其在临床实践中的实用性。ctDNA检测使研究人员能够比传统影像学检查更早地检测出患者的转移性乳腺癌复发,并在出现临床症状之前开始治疗,从而改善生活质量和生存结果。虽然目前还没有足够的证据证明对所有患者使用ctDNA筛查是合理的,但它可能是一种有价值的工具,适用于患有更具侵袭性或高风险疾病的患者。多项研究已证明ctDNA在乳腺癌患者中早期检测复发和指导治疗决策方面均具有临床有效性。连续检测对于监测患者的整个癌症进程是必要的,了解不同癌症亚型的动力学对于确定适当的检测间隔至关重要。
最近,美国医疗保险扩大了乳腺癌ctDNA检测的覆盖范围,减轻了患者原本要承受的经济负担。随着研究人员对ctDNA检测及其检测复发能力的深入了解,可以通过制定方案确定何时筛查收益大于成本。缺乏强有力的前瞻性或随机对照试验是当前ctDNA应用的一个限制,需要进行更多研究来确定最佳的ctDNA筛查方法。然而,正如本文病例所示,在肿瘤学中应用ctDNA检测可取得具有影响力的结果,对乳腺癌治疗的未来大有裨益。
研究人员同意Sant等人的观点,即有必要加大技术力度并制定在临床实施液体活检的标准方案。与肿瘤内科、肿瘤影像科、放疗科和其他参与患者治疗的专家合作对于研究和实施这些检测以及改善未来临床试验的结果至关重要。通过ctDNA检测早期发现转移性乳腺癌可能有助于实现更加个性化和有效的治疗,从而有可能提高乳腺癌患者的生存率和生活质量。通过将ctDNA检测应用到临床实践中,研究人员可以采取更积极主动的方式筛查转移和分子复发来治疗患者。本文病例展示了这种方法的可能性,并主张将ctDNA检测纳入临床实践以改善乳腺癌治疗。
参考文献:
Michael A. Durka, Eemon Tizpa, Brian D. Lawenda,The use of ctDNA MRD precision medicine surveillance after definitive treatment of early-stage, high-risk breast cancer in a radiation oncology practice: A case series,https://doi.org/10.1016/j.cpccr.2024.100295.



