唐本忠院士/李莹教授/王东教授 《ACS AMI》:内质网靶向聚集诱导发光材料协同格列苯脲消除肿瘤。
时间:2023-11-03 17:42:57 热度:37.1℃ 作者:网络
癌症对人类威胁最大的疾病之一,迫切需要发现和开发新型抗癌药物。真核细胞的内质网负责蛋白质处理、修饰、组装和折叠,各种微环境因素如缺氧、营养剥夺和活性氧(Reactive oxygen species,ROS)可以损伤内质网,加速未折叠或错误折叠蛋白的积累,并启动随后的未折叠蛋白反应(Unfolded protein response,UPR)。尽管UPR导致的细胞死亡使得内质网成为肿瘤治疗的潜在目标,然而,癌细胞可以从持续的慢性内质网应激介导的代谢重编程中增强血管生成、肿瘤转移和耐药性。因此,如何优化内质网应激靶向的抗癌治疗策略成为一道亟待解决的难题。

近期,港中深唐本忠院士,广州医科大学李莹教授,深圳大学王东教授等人开发了一种以2,6-二甲基吡啶为骨架的三苯胺衍生物TPA-DMPy。该分子除了具有AIE特征,诱导I型活性氧产生以及结合并标识细胞内质网的能力以外,还可以与抗糖尿病临床药物格列苯脲(Glibenclamide)协同,在光照下诱导癌细胞迅速而不可逆的死亡。
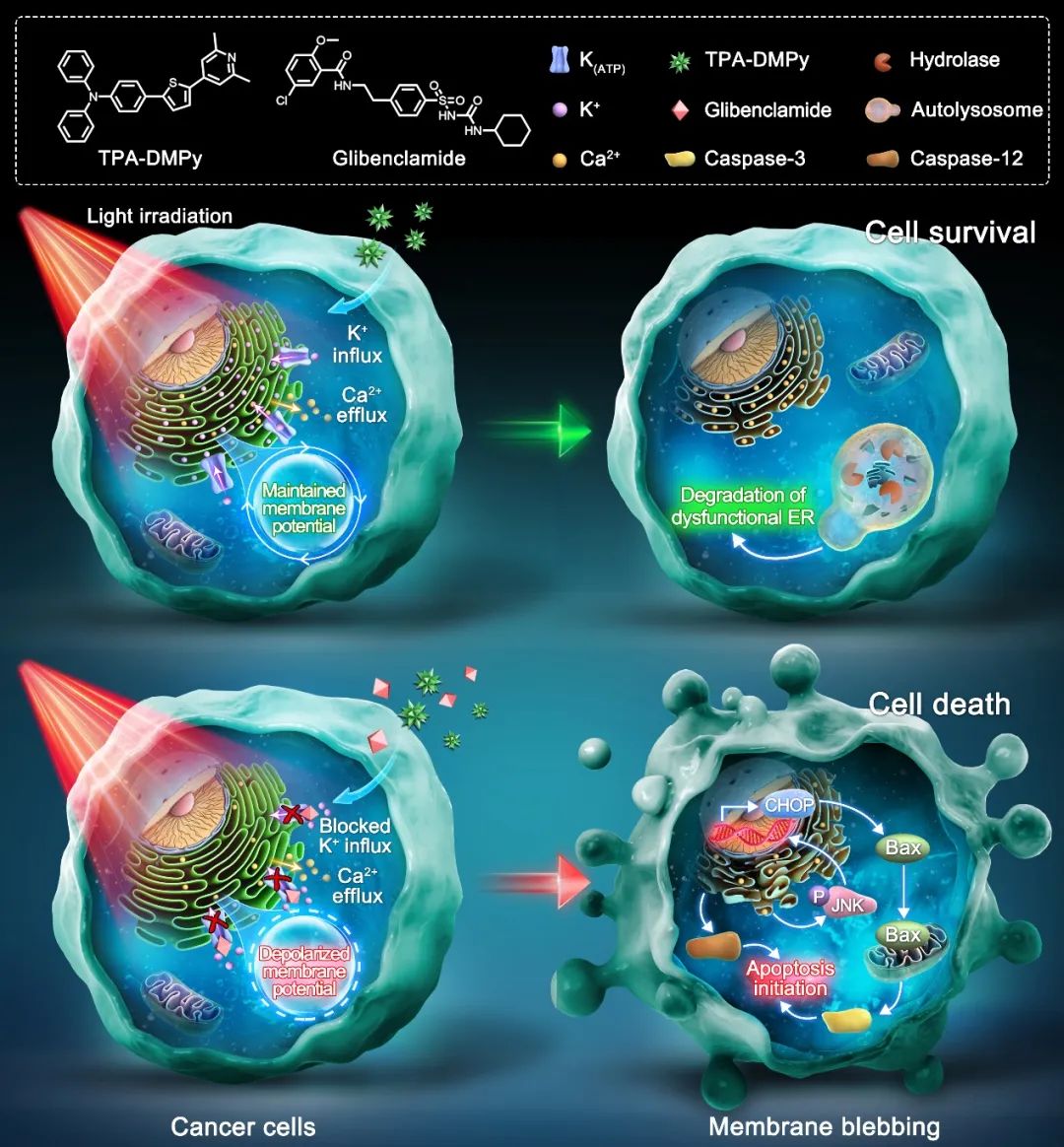
图1、TPA-DMPy与格列苯脲协同诱导癌细胞凋亡的机制
内质网中蛋白质的正常折叠非常依赖于腔内钙 (Ca2+),而内质网Ca2+的消耗可能通过破坏Ca2+依赖性的伴侣蛋白的功能来导致灾难性的内质网应激和癌细胞的凋亡。然而,通过诱导Ca2+从内质网释放到细胞质来对抗癌症的策略尚未得到关注,这可能是因为内质网膜上多个离子通道协调维持了Ca2+稳态,而细胞凋亡的启动取决于Ca2+从细胞质转移到线粒体。有趣的是,内质网Ca2+的摄取和释放引起跨膜电荷运动。相应的,内质网膜上的几个钾离子通道,包含ATP依赖型钾离子通道(KATP),则会参与Ca2+流动后的膜两侧电位的平衡。由于稳定的电化学梯度对于调节内质网中Ca2+的跨膜通量是必要的,因此,在诱导内质网Ca2+释放的同时关闭代偿性离子通道的治疗手段可能是一种很有前途的抗癌策略。
在这项研究中,作者首先表征了分子TPA-DMPy的内质网靶向功能。然而,通过共聚焦显微镜(CLSM)观察发现,共染TPA-DMPy及商染ER-Tracker Red的癌细胞迅速出现了细胞膜起泡现象,而这种现象已被证实为细胞凋亡的开始。反之,单独使用TPA-DMPy并没有导致这一情况。ER-Tracker Red能结合内质网依赖于其上的格列苯脲基团,后续的CLSM也进一步证实了TPA-DMPy与格列苯脲同样可以诱导细胞膜起泡。
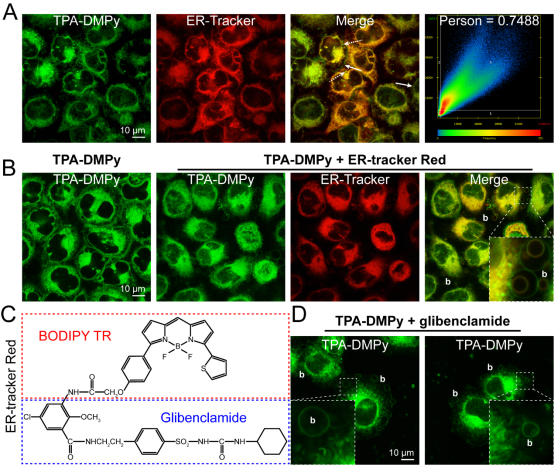
图2、内质网靶向TPA-DMPy和格列苯脲协同诱导癌细胞膜起泡。
随后,作者利用细胞毒性试验验证了TPA-DMPy与格列苯脲之间的协同抗癌效果。此外,还通过CLSM以及TEM直接观察了癌细胞在两种药物单独处理及协同处理下的形态学变化。尤为明显的是,TPA-DMPy与格列苯脲联合处理的癌细胞出现了严重的内质网肿胀断裂以及大量凋亡小体的出现。同时,作者还提出,TPA-DMPy单独使用时没有有效引起细胞死亡可能是因为药物处理激活了自噬反应来清除受损的内质网,以防止过度的内质网应激来诱导凋亡。
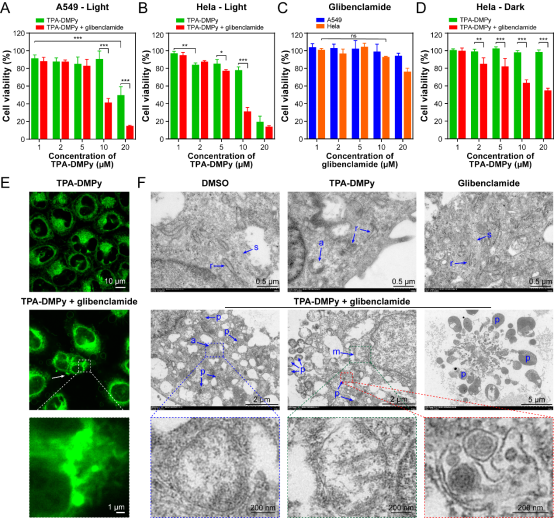
图3、MTT细胞毒性法、CLSM及TEM成像观察TPA-DMPy与格列苯脲协同诱导癌细胞死亡。
此外,为了了解TPA-DMPy与格列苯脲协同抗癌的具体机制,作者先是通过免疫印迹法检测了细胞凋亡的具体通路。结果发现,在光照情况下TPA-DMPy与格列苯脲联用可以同时激活依赖于Caspase-12的内质网途径细胞凋亡以及依赖于Caspase-3的线粒体途径细胞凋亡。相反,无论是TPA-DMPy还是格列苯脲都无法显著提升这两条通路。进一步的研究发现,TPA-DMPy强烈诱导了Ca2+从内质网向细胞质释放。而且只有当内质网膜上的KATP被格列苯脲关闭时,Ca2+的释放才能引起癌细胞凋亡。相反,无论是关闭其它类型的钾离子通道或是单纯加强Ca2+的释放都无法起到促进细胞凋亡的结果。此外,作者还使用了另一种KATP抑制剂Glibornuride进一步验证了同时诱导内质网Ca2+的释放并关闭KATP可以有效导致癌细胞凋亡。
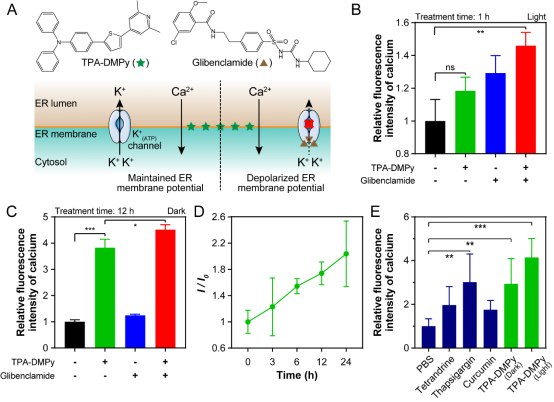
图4、联合使用TPA-DMPy和格列苯脲使得癌细胞内质网膜电位去极化。
最后,作者还利用皮下瘤模型验证了TPA-DMPy与格列苯脲协同抗癌的体内活性。结果发现,在一共给予3次治疗后,肿瘤大小缩减至原始尺寸的10%左右。然而,单独使用TPA-DMPy则只能勉强抑制肿瘤生长,在为期16天的治疗后,肿瘤尺寸仍然增长了一倍。单独使用格列苯脲对肿瘤生长几乎没有影响。这些结果进一步说明了TPA-DMPy与格列苯脲存在显著的协同抗癌作用。同时,通过对主要脏器进行切片病理检查及肝肾功能检查确定了这种联合治疗对小鼠没有明显的毒性。
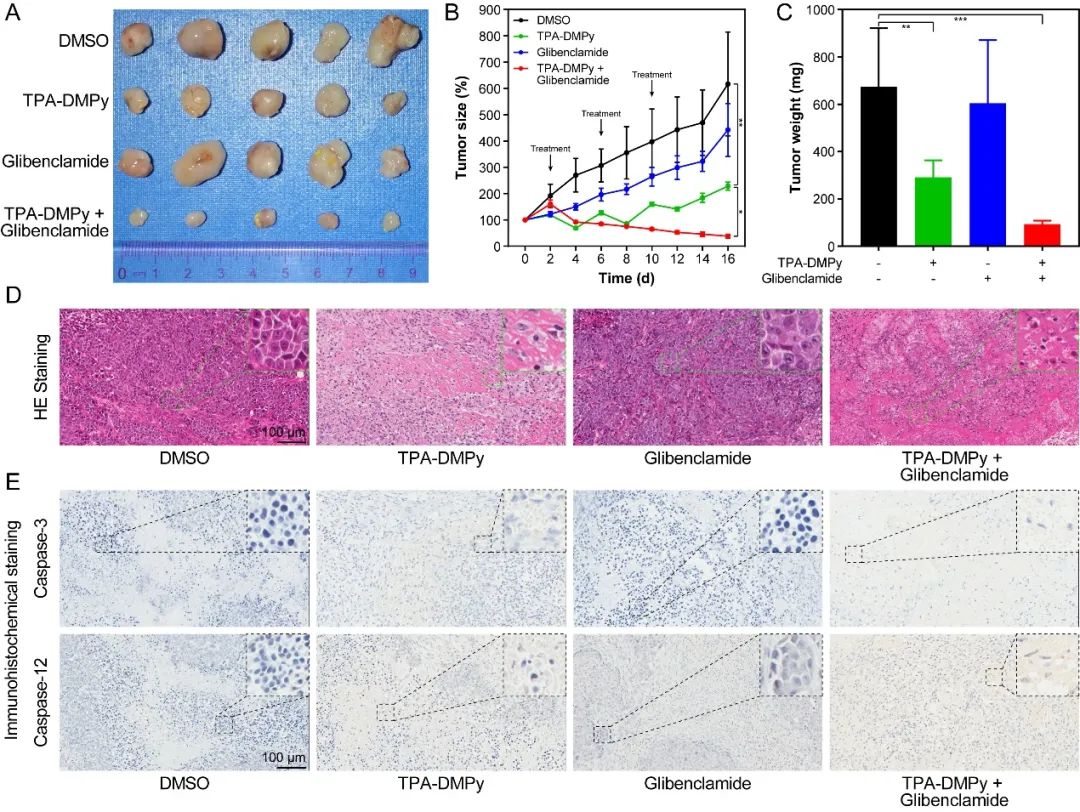
图5、小鼠皮下瘤模型下TPA-DMPy和格列本脲协同促进肿瘤消融。
港中深唐本忠院士,广州医科大学李莹教授,深圳大学王东教授为该论文的共同通讯作者,博士后吴逸璠、陈晓辉(现广东医科大学)为本论文的共同第一作者。本研究受国家重点研发计划、国家自然科学基金、深圳市科学技术基金、深圳市功能性聚集体材料重点实验室等项目资助。


