罕见病例|脓毒症合并自发性脾破裂出血1例
时间:2023-09-14 20:04:19 热度:37.1℃ 作者:网络
脓毒症是宿主对严重感染反应失衡所致危及生命的多器官功能障碍,是ICU的常见疾病。脓毒症往往合并多器官功能不全,如心功能不全、肾功能不全、肝损伤[1]、脓毒症相关性脑病、凝血功能障碍等;一旦感染播散至腹腔,还可诱发脾脓肿,甚至自发性脾破裂出血,危及生命。自发性脾破裂发病率低,起病隐匿,症状不典型,临床容易漏诊。本例脓毒症患者反复高热,突发意识障碍、血压骤降伴血红蛋白进行性下降,急诊腹部CT示:脾周混杂高密度影,考虑脾破裂出血。肝胆外科急诊行剖腹探查术,术中发现脾脏包膜破裂、脾周血肿明显,遂行全脾切除术。现报告1例脓毒症合并自发性脾破裂出血病例,旨在提高对本病的认识,采取积极措施,降低病死率,改善临床结局。
1病例资料
患者男性,45岁。患者1个月前(2022年9月15日)无明显诱因出现畏寒发热,最高体温39.0 ℃,于当地医院就诊,给予美罗培南联合万古霉素抗感染、盐酸溴己新化痰、补液等对症支持治疗。10月18日患者突发氧合下降,血压降低,紧急气管插管、补液升压后,转诊至武汉大学人民医院。既往史:2019年6月于本院行全主动脉弓人工置换+升主动脉部分切除+支架象鼻术,术后声带麻痹、声嘶;精神分裂病史10余年,间断口服奥氮平、丙戊酸钠缓释片;否认吸烟史、饮酒史、高血压、糖尿病、肝炎、结核等特殊病史。入院查体:体温36.3 ℃;心率142次/min;呼吸26次/min;血压76/60 mmHg,去甲肾上腺素泵维持,镇痛镇静状态,气管插管呼吸机辅助呼吸,极度消瘦貌,全身皮肤巩膜无黄染,浅表淋巴结无肿大,胸前正中可见长约20 cm的手术疤痕,颈软,气管居中,心率齐,各瓣膜区未闻及病理性杂音,双肺呼吸音粗,满布痰鸣音及湿啰音,腹软,肝脾肋下未触及,无压痛及反跳痛,骶尾部及髋部皮肤压疮,双下肢无水肿。
入院后完善相关辅助检查,血常规:WBC 8.72 ×109/L, Neu% 82.30%, RBC 2.57×1012/L, Hb 79 g/L, PLT 27×109/L, CRP 240 mg/L, SAA 300 mg/L;凝血功能:PT 13.7 s, APTT 37.2 s, TT 12.60 s, FIB 3.54 g/L, D-dimmer 30.06 mg/L, AT- Ⅲ 38.7%;氨基末端脑钠肽:pro-BNP 13 897 pg/mL;降钙素原:PCT 74.15 ng/mL;心梗三项:MYO 1 000 μg/L, cTnI 0.165 ng/mL;生化:ALT 25 U/L, AST 59 U/L, Alb 21.80 g/L, BUN 19.60 mmol/L, Cr 213 μmol/L, K 3.25 mmol/L, GRF 31.42 mL/min;血气分析:pH 7.41, PaO2 152 mmHg, PaCO2 35 mmHg, Lac 3.0 mmol/L;真菌G试验:77.091 pg/mL。细胞免疫功能:CD3 60.55, CD4 53.46, CD8 7.26, CD4/CD8 7.36;体液免疫:IgG 8.83, C3 0.433, C4 0.04。下呼吸道病原菌(10/20):金黄色葡萄球菌及耐甲氧西林葡萄球菌-DNA阳性。呼吸道病原学高通量测序(10/21):金黄色葡萄球菌(覆盖度99.54%)、肺炎链球菌(覆盖度99.28%)、白色念珠菌(覆盖度95.28%)。外周血病原学高通量测序(10/21):金黄色葡萄球菌(覆盖度99.61%)、热带念珠菌(覆盖度93.27%)。血培养(10/23):金黄色葡萄球菌。尿培养(10/24):白色念珠菌。心电图(10/18):房性心动过速;V2导联ST段抬高。腹部彩超(10/19):脾脏包膜完整,实质回声分布均匀;腹水彩超(10/19):未见明显异常;心脏彩超(10/19):主动脉夹层术后,置换人工血管未见明显异常。入院诊断:(1)脓毒血症,脓毒性休克,金黄色葡萄球菌性败血症;(2)急性呼吸衰竭;(3)肾功能不全;(4)肝功能不全;(5) 血小板减少;(6)心功能不全;(7)低蛋白血症;(8)低钾血症;(9)精神分裂症;(10)凝血功能异常;(11)受压区压疮;(12)心律失常;(13)血管支架植入术后状态。
第一天患者反复高热,留取血、尿、痰培养,完善纤支镜检查并加强抗感染治疗。第二天,完善外周血行高通量测序(NGS)。第三天,试脱机半小时后血气未见明显异常(pH 7.46, PaO2 135 mmHg, PaCO2 33 mmHg),遂拔除气管插管。第四天,血培养提示金黄色葡萄球菌感染,加用万古霉素抗感染。第五天,患者仍有发热,体温高达39.5 ℃,胸片提示双肺散在斑片影,外周血NGS及血培养均提示金黄色葡萄球菌感染,同时外周血及痰NGS提示真菌感染(热带念珠菌、白色念珠菌),加用米卡芬净抗真菌治疗。第六天,患者突发血压骤降(55/30 mmHg),呼之不应,氧饱和度测不出,遂紧急行气管插管术。第七天,患者血红蛋白从102 g/L骤降至68 g/L,肝酶急剧升高(ALT 569 U/L, AST 1 474 U/L)伴肾功能不全(BUN 32.1 mmol/L, Cr 196 μmol/L) 及严重低蛋白血症(Alb 26.5 g/L)。考虑消化道出血可能,输注浓缩红细胞,同时加强抑酸抑酶等对症处理。第八日,患者病情继续恶化,体温峰值39.9 ℃,重度贫血、肝肾功能不全及凝血功能障碍(PT 16.7 s, APTT 42.8 s, D-dimmer 92.97 mg/L)进行加重。患者反复多次输血(4U浓缩红)后血红蛋白未见明显上升,无呕血及黑便,查体全腹膨隆、左上腹压痛可疑阳性,紧急完善腹部检查。腹部B超(10/27):脾周异常包块声影伴腹腔积液。腹部CT(10/27):脾脏低密度影,脾周混杂高密度影,考虑出血;腹腔大量积液(图1)。肝胆外科及介入急会诊,考虑脾破裂出血可能性较大,急诊行剖腹探查术。术中见脾脏肿大,近脾门及脾膈面分别见长约3 cm及6 cm裂口,深约2 cm,部分被膜撕脱(图2),行全脾切除术。术后第一天,患者仍高热39.6 ℃,给予物理降温、强化抗感染、小剂量激素联合双氯芬酸钠栓对症处理后,体温逐渐恢复正常。术后第二天,考虑患者肾功能不全以及药物肾毒性,停万古霉素改为达托霉素联合米卡芬净抗感染治疗。术后第三天,评估后拔除气管插管给予高流量氧疗,继续抗感染、补液等对症支持治疗。术后病理报告(11/3):脾门处血管呈慢性炎症,免疫组化示:CD20(灶状+),CD3(灶状+), CD5(灶状+), CD56(-), Ki-67(+, 低增殖),原位杂交:EBER(-),考虑脾脓肿伴出血(图3)。术后第七天,患者神志清楚,无发热,感染指标较前显著下降,转回当地医院继续治疗。
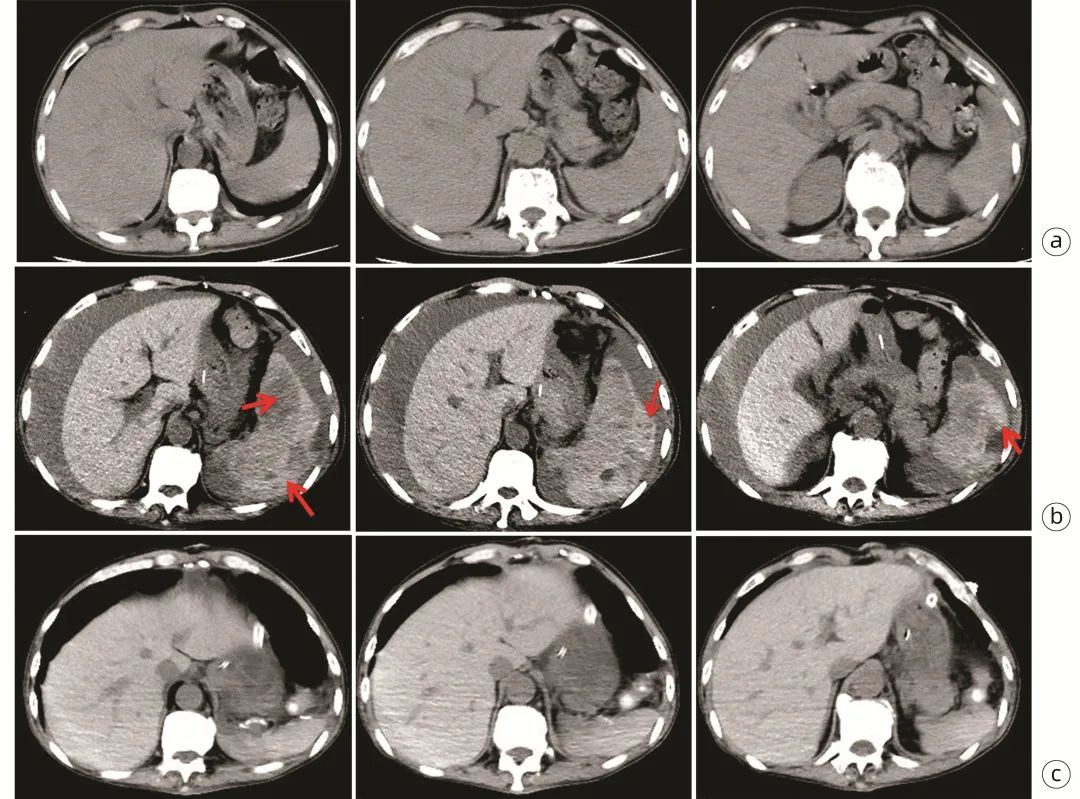
图1 腹部影像
注:a,腹部CT(9/27):脾脏包膜完整未见明显异常;b,腹部CT(10/26):脾破裂,脾周血肿、腹腔大量积液(箭头示);c,腹部CT(11/01):脾切除术后,脾区少量积血积液。
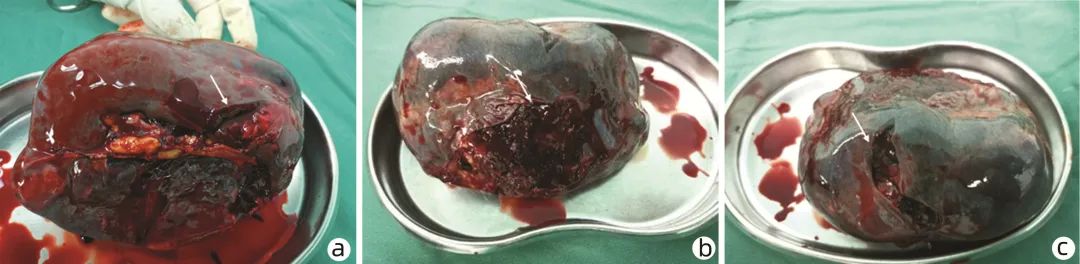
图2 脾脏大体
注:a,脾脏近脾门处可见一长约3 cm裂口(箭头示);b,脾膈面的包膜撕裂,破裂口约8 cm×4 cm(箭头示);c,脾膈面不规则大裂口,长约6 cm,深约2 cm(箭头示)。
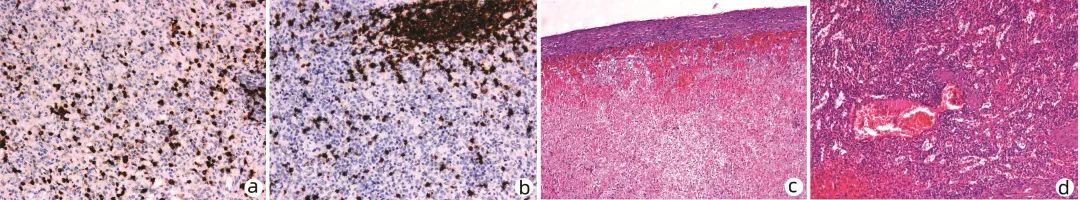
图3 脾脏标本病理
注:a,CD3局灶阳性(免疫组化,×100);b,CD20片状阳性(免疫组化,×100);c,脾脏被膜下出血伴大量炎性细胞浸润(HE,×40);d,脾脏内血管扩张伴炎性细胞浸润(HE,×100)。
出院诊断:(1)脾脓肿,非创伤性脾破裂;(2)脓毒性休克,金黄色葡萄球菌性败血症;(3)多脏器功能衰竭;(4)热带念珠菌感染;(5)重症肺炎;(6)腹腔感染;(7)真菌性泌尿道感染;(8)电解质紊乱;(9)血小板减少;(10)低蛋白血症;(11)房性心动过速;(12)凝血功能异常,低纤维蛋白原血症;(13)多浆膜腔积液,胸腔积液,腹腔积液,盆腔积液;(14)高胆红素血症,胆汁淤积;(15)受压区压疮;(16)精神分裂症;(17)血管支架置入术后状态。
2讨论
脓毒症是ICU的常见疾病,病死率较高[2],以脓毒症休克[3]、难治性低血压、微循环障碍、乳酸进行性升高为特点,导致多器官功能不全甚至衰竭[4]。脓毒症合并脾脓肿,诱发自发性脾破裂出血十分罕见[5],发病率仅为0.1%~0.5%[6],临床上容易忽视及漏诊,导致严重不良结局。
自发性脾破裂是指无明确外伤史而发生的脾脏突发性或隐匿性破裂。Rokitansky于1861年首次在2例白血病患者中提出此概念[7]。嗜酸粒细胞增多症[8]、传染性单核细胞增多症[9]、恶性肿瘤[10-11]、血液系统疾病[12]、白血病[13]、结核[14]、疟疾[15]、伤寒[16]、慢性肝炎[17]、立克次体[18]及血吸虫感染[19]等,均可导致脾脏充血肿大且脆性增加,最终诱发脾破裂。脾脏自身病理性改变,如脾囊肿[20]、脾血管瘤[21]及脾血管肉瘤[22]等,往往影响单核巨噬细胞系统导致脾脏脆性增加,易诱发脾破裂。感染性疾病、炎症及免疫系统异常激活,诱发脾肿大或与周围组织粘连,脾脏活动度降低,因此腹压增加或体位改变等动作即可诱发自发性脾破裂[23]。由于无明确外伤史且缺乏典型症状和体征,本病极易漏诊[6]。患者一般无明显诱因,咳嗽、喷嚏、排便、剧烈呕吐、分娩等腹压增加动作,导致膈肌及腹肌强烈收缩,均可诱发脾破裂[20]。自发性脾破裂患者通常表现为突发左上腹持续疼痛,伴恶心呕吐、腹胀等症状,严重时可伴重度贫血或循环衰竭,危及生命。部分患者可出现Kehr’s征,阳性率70%~80%[24],即脾周积血刺激左侧膈肌,导致左上腹疼痛及左肩放射痛。因左肩放射痛,Kehr’s征易被误诊为急性心血管疾病。诊断性腹腔穿刺、B超、CT及血管造影均为该病常见的辅助检查。腹腔穿刺术简单实用,若抽出不凝血,可协助诊断。B超/CT可间接显示脾破裂的位置、范围及深度,脾周血肿及腹腔积血情况。血管造影则对血管破裂的自发性脾破裂诊断价值较高。若脾破裂严重出血,出血量大且速度快,患者常表现为重度贫血或低血压休克,甚至循环衰竭,危及生命。
脓毒症导致脾脓肿发生相对较少,而脾脓肿合并自发性脾破裂则十分罕见[5],其机制尚不明确。本例自发性脾破裂出血可能与以下多因素相关:(1)脓毒症金黄色葡萄球菌血流感染,侵袭脾脏导致急慢性炎症,大量白细胞及中性粒细胞聚集,IL-1、IL-6等炎症因子释放,免疫损伤导致脾脏局部脓肿、坏死,诱发自发性脾破裂[25];(2)感染导致机体免疫系统异常激活,脾脏作为外周免疫应答的重要场所,启动T、B淋巴细胞活化,炎症信号通路激活,血管通透性增加导致脾肿胀[26];(3)重症感染导致凝血功能异常,抗凝血酶Ⅲ减少,蛋白C及S活性降低,D-二聚体升高,血液高凝,脾脏微血管内纤维蛋白血栓增多,血流灌注不足[27];(4)脓毒症患者内毒素异常升高导致脾交感神经兴奋,神经电活动强度升高,潜伏期缩短,脾脏血流灌注减少;(5)金黄色葡萄球菌分泌致病性溶血素,可诱导脾脏细胞发生依赖于caspase的程序性死亡,同时促使小血管平滑肌收缩、痉挛,导致血流阻滞和组织局部缺血坏死[28];(6)金黄色葡萄球菌释放穿孔素、溶血素等,干扰固有免疫系统,诱导机体IL-1、IL-6分泌;同时,诱导中性粒细胞凋亡,抑制巨噬细胞吞噬活性,介导脾脏免疫损伤[25]。最新研究[29]表明COVID-19感染也是患者自发性脾破裂的高危因素,SARS-CoV-2可损伤脾脏及淋巴结,导致脾萎缩,同时微血栓形成及凝血功能异常,均可导致脾脏血流灌注不足甚至脾破裂。
本例脓毒症合并自发性脾破裂出血经验如下:首先,本例脓毒症患者证实为金黄色葡萄球菌感染,极易导致细胞坏死甚至脾脓肿。金黄色葡萄球菌释放溶血素、穿孔素,侵蚀血管可致局灶性出血逐渐融合,脾脏血肿,严重时可导致包膜破裂出血。其次,严重血流感染的患者,需考虑是否合并其他脏器感染。既往支架异物置入史,反复多次血流感染的患者,治疗过程中发生不明原因血红蛋白下降,需警惕脾破裂的可能。本例患者血压骤降伴不明原因血色素骤降,且无呕血便血症状,排除消化道出血的同时,需积极完善腹部检查。临床诊疗不仅需选择敏感抗生素,同时需考虑药物的代谢及分布,选择对靶器官通透性更优的药物。自发性脾破裂一旦确诊,需立即制订诊疗方案,包括手术治疗及非手术治疗,以手术治疗为主。本例脓毒症患者合并自发性脾破裂,需强调多学科合作诊疗模式。ICU医师需不断强化对脓毒症的认知水平,关注病情变化的同时积极思考,若患者突发左上腹疼痛伴血红蛋白骤降,需考虑本病可能,密切监测生命体征并完善相关辅助检查,一旦确诊尽早治疗,降低病死率,及时挽救生命。
全文下载
柳舟, 夏文芳, 詹丽英, 等. 脓毒症合并自发性脾破裂出血1例报告[J]. 临床肝胆病杂志, 2023, 39(8): 1926-1931


