Cell发布迄今最完整的发育中人类胚胎肺部细胞图谱,鉴定生命早期144种肺细胞状态
时间:2023-01-03 15:02:51 热度:37.1℃ 作者:网络
导读
近年来,成年人健康和疾病时肺脏细胞的单细胞图谱正以越来越高的分辨率进行构建,为理解肺细胞生理学提供了基础。但成人肺的细胞更新率很低,科研人员难以捕获过渡状态和祖细胞,并且一些发育特异性的细胞状态在成人体内不存在。人类胚胎和胎儿肺的高分辨率细胞图谱将有助于识别发育前体和祖细胞,并可预测细胞的分化轨迹和潜在的基因调控网络,作为研究肺部疾病起源的基线。
胚胎发育的最初几周是非常动态,随着器官构建过程在各个阶段之间的变化,细胞类型迅速出现和消失。当芽尖上皮细胞分化进入周围的中胚层时,留在茎部的上皮细胞开始分化为细支气管和肺泡上皮,表明空间的位置反映了肺发育的时间进程。因此,将单细胞状态分析与体内空间可视化相结合,可为在发育中的肺中识别新的祖细胞提供更高可信度。
近日,英国Sanger研究所、EMBL欧洲生物信息学研究所(EMBL- ebi)等单位的研究人员在Cell发表了题为“A human fetal lung cell atlas uncovers proximal-distal gradients of differentiation and key regulators of epithelial fates”的文章。研究团队使用scRNA-seq、scATAC-seq、Visium空间转录组学和杂交链式反应的mRNA原位杂交技术,构建了人类胚胎肺发育的高分辨率单细胞图谱。结合这些数据资源,研究团队共识别出144种细胞状态(或类型),包括先前未鉴定的祖细胞类型、过渡细胞类型以及与人类小细胞肺癌(SCLC)亚型相关的神经内分泌细胞亚型。该研究不仅描述了肺部形成时产生的单个细胞状态,还描述了受基因调控的细胞发育全过程。
 文章发表在Cell
文章发表在Cell
主要研究内容
人类胚胎肺发育时空图谱共鉴定出144种细胞状态
研究团队对5-22PCW(post-conception weeks)时期的肺样本进行scRNA-seq和scATAC-seq。为了更好、更全地识别细胞状态,对15、18、20和22 PCW的肺进行了深度采样,分离了近端和远端区域,同时保持5、6、9和11pcw的肺完整,生成了高质量的转录组和DNA可及性数据。研究团队将这些细胞大致划分为成纤维细胞、上皮细胞、内皮细胞和红细胞/白细胞谱系。其中,成纤维细胞是占比最高的细胞,特别是在年轻的肺中;所有肺样本中均观察到了白细胞和红细胞,但其在B、T和NK细胞中是从15PCW开始才出现的。
研究团队基于标记基因对各细胞亚群进行进一步的细胞类型注释,共识别出144种细胞状态。集群主要分为三个不同的区域:早期(5,6pcw)、中期(9-11 pcw)和晚期(15-22pcw)。此外,研究发现,样本年龄是细胞聚类的重要决定因素,反映了细胞成熟度随时间的推移;细胞周期状态和解剖区域也与细胞聚类相关。

图1. 数据及实验概述。来源: Cell
发育中的气道中存在两种神经内分泌细胞亚型
经检测,最早分化的上皮细胞是5PCW肺中的神经内分泌(NE)细胞(图2)。研究团队确定了两种类型的NE细胞:经典肺NE细胞(GRP)和GHRL NE细胞(TTR,GHRL),这与近期发布的人类胎儿细胞图谱一致。此外,研究团队观察到NE细胞成熟度随着时间的推移而增加。
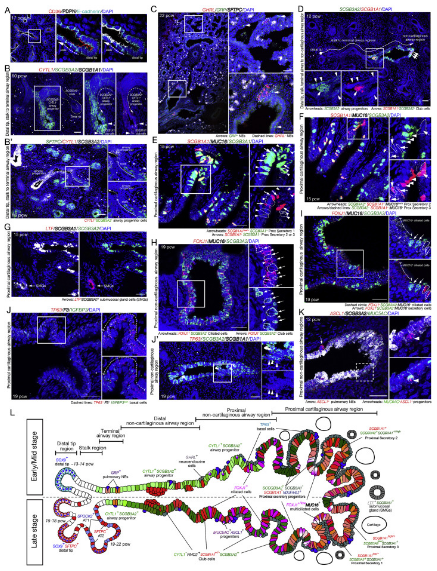
图2. 使用原位HCR对发育中人肺气道上皮细胞进行空间分析。来源: Cell
成纤维细胞在不同生态位的功能多样性
研究团队使用CellPhoneDB预测了调控细胞命运的互作分子对。以15-22PCW细胞为研究对象,依据主要成纤维细胞群的定位,分析了三个生态位(ecological niche)内的信号通路(图3)。气道生态位(airway niche)包括气道成纤维细胞、气道晚期平滑肌细胞和气道上皮细胞;肺泡生态位(alveolar niche)包括肺泡成纤维细胞、肺细胞、晚期帽细胞,AT1和AT2;外膜生态位(adventitial niche)包括外膜成纤维细胞、动脉内皮细胞、OMD阳性内皮细胞和血管平滑肌细胞。
研究团队观察到了预测的相互作用,包括外膜生态位中高水平的Notch配体和受体,CXCL12-CXCR4受配体对信号等。同样地,在肺泡生态位中,分析得到的信号通路包括肺细胞与晚期帽细胞的互作(ALPN-ALPNR)、肺泡上皮细胞与微血管内皮细胞的互作(VEGFA-FLT1/FLT4/KDR)。最后,研究团队用原位组织染色对上述预测得到的受配体对进行了验证。

图3. 成纤维细胞在不同生态位的互作信号。来源:Cell
神经内分泌细胞亚型形成的转录调控
肺NE细胞和GHRL NE细胞有许多相同的转录因子(TF)表达和染色质开放区域,但两者在转录上是不同的。在scRNA-seq数据中,两者都是沿着成熟轨迹存在,并且共享经典NE标记基因(CHGA、SYP);但两者在某些TF和激素表达上存在差异。
拟时序分析表明,肺NE和GHRL NE细胞来源于气道祖细胞,中间NE细胞是额外的过渡群体。肺NE前体细胞可获得NEUROG3转化为GHRL NE细胞;反之,GHRL前体细胞也可转化为肺NE细胞。在原位组织切片中,ASCL1与GRP共表达,但很少与GHRL共表达。
前期研究发现,ASCL1和NEUROD1的差异表达决定了A型和N型人类SCLC,其可能起源于NE细胞。研究团队还生成了SCLC特征基因集,并进行了基因特征评分。结果显示,A型SCLC类似于肺NE细胞,N型SCLC类似于GHRL NE细胞。上述结果表明,人类SCLC有两种不同的NE细胞起源。
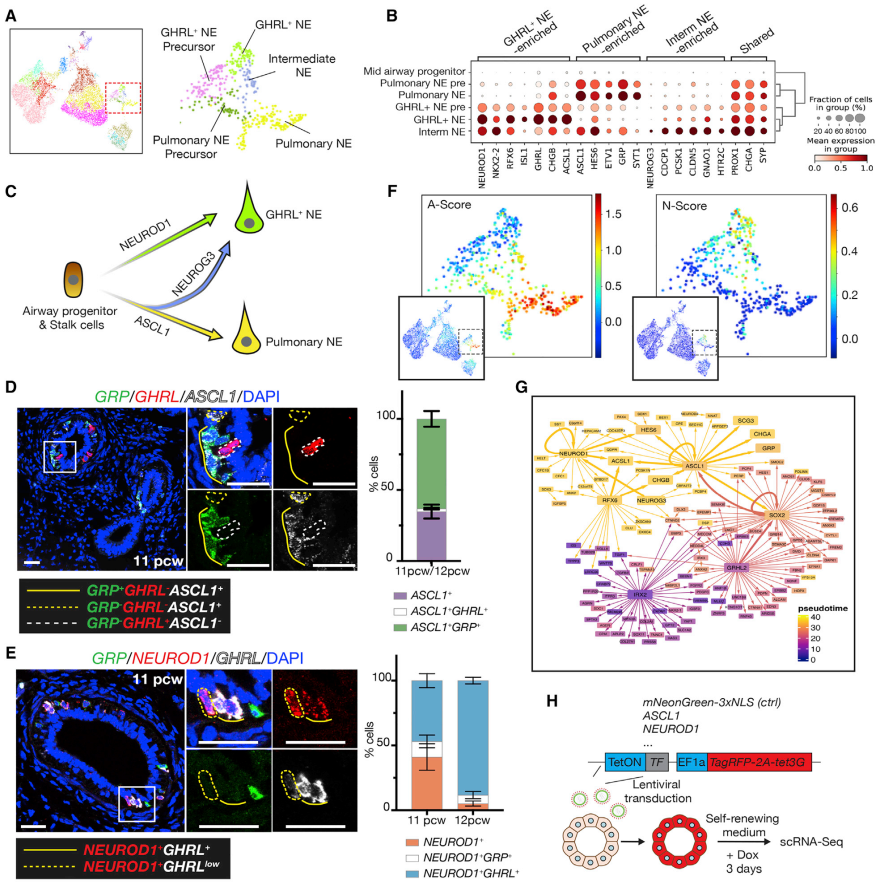
图4. ASCL1和NEUROD1调节两种亚型NE细胞的形成。来源: Cell
结 语
综上所述,研究团队通过单细胞和空间技术的结合,利用获得的5-22 PCW的人类胎肺样本,鉴定了发育中人类胚胎肺部的144种细胞类型/状态。该研究为将单细胞数据集与人体类器官系统的组织空间分析和功能分析相结合提供了一种范式,为人类肺发育提供了更加深入的调控机制见解。同时,该研究提供的图谱数据也是未来人类生理、再生和疾病研究的宝贵资源。
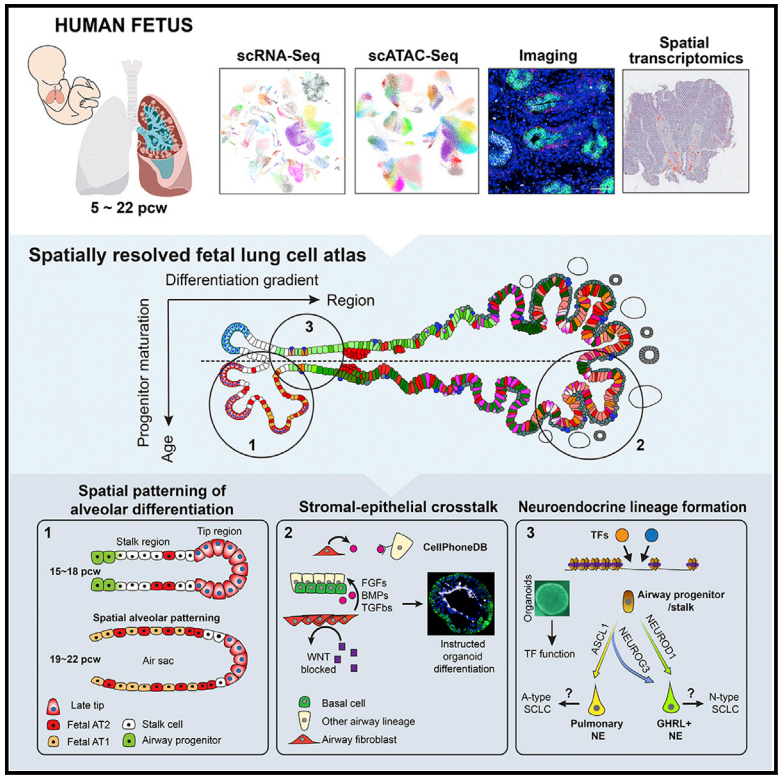
图5. 总研究概要图。来源: Cell
该研究参与作者、人类细胞图谱项目的联合创始人Sarah Teichmann教授表示:“完整的人类细胞图谱详细描述了生命的各个阶段,将有助于解释人类健康和疾病状态,尤其是生命早期形成的器官组成部分。肺发育细胞图谱使我们能够了解成年肺细胞经历的阶段和途径,以及这些早期阶段如何影响以后的疾病发生等。同时,这也是对人类细胞图谱计划的重要贡献。”


