JGLD:Sofosbuvir + Velpatasvir + Voxilaprevir在基因1b型HCV感染患者中对DAAs治疗无反应的真实疗效和安全性
时间:2022-12-26 14:59:55 热度:37.1℃ 作者:网络

背景:丙型肝炎病毒(HCV)是一种具有7种主要基因型的黄病毒,其主要污染途径是不安全的药物注射和不安全的医疗程序。丙型病毒性肝炎仍然是全世界的一个公共卫生问题。世界卫生组织2015年的最新评估报告显示,有7100万人慢性感染丙肝病毒。在全球范围内,HCV基因型1和3最常见,分别占病例的46.2%和30.1%,而基因型2、4、5和6分别占病例的不到10%(9.1%、8.3%、5.4%和<1%)。在罗马尼亚,HCV感染的总体患病率低于先前报道的(1.39%),基因1b型占主导地位(99.6%)。治疗HCV感染的治疗目标是获得持续的病毒反应(SVR),必须消除所有准物种。在罗马尼亚,超过3.9万人接受了直接作用抗病毒药物(DAAs)治疗,96%以上实现了SVR。我们之前报道的ombitasvir/paritaprevir/ritonavir和dasabuvir (OPrD)的失败率为2.7-3.6%,ledipasvir/sofosbuvir (SOF)的失败率为3.1%,forelbasvir/grazoprevir的失败率为2.9%,它们与初始NS5A方案无关,总体失败率相似。某些病毒学因素可能预测DAAs失败,如HCV基因型1a和3,已被证明比其他基因型更难治愈,特别是在肝硬化患者和感染了耐药相关替代病毒的患者中,要么在基线时表现为自然多态性,要么在DAAs失败后表现为选择。
蛋白酶抑制剂voxilaprevir (VOX)联合NS5A抑制剂SOF和NS5A抑制剂velpatasvir (VEL)的批准为临床医生提供了针对HCV复制所有步骤的有效再治疗选择。SOF/VEL/ VOX联合疗法已经在800多名参加II期和III期研究的患者中进行了评估,在这些研究中,SOF/VEL/ VOX联合疗法表现出出色的安全性和有效性,总体SVR率超过95%。
目的:这项研究的目的是评估SOF/VEL/VOX在真实世界研究中的有效性和安全性,包括之前接受过基因1b型HCV感染治疗的患者,这些患者之前的DAAs治疗没有获得持续的病毒反应。
方法:在罗马尼亚,通过2019-2020年的一项全国性政府资助项目,213例对以前的DAAs治疗无反应的慢性丙型肝炎患者接受SOF/VEL/ VOX 400/100/100 mg/天的治疗,持续12周。我们进行了一项回顾性纵向研究,包括在布加勒斯特、iai、Craiova和constana诊所接受治疗的143名患者,均为基因1b型HCV感染患者。疗效通过治疗后12周达到SVR (SVR12)的患者百分比进行评估。登记了严重不良事件(SAE)。
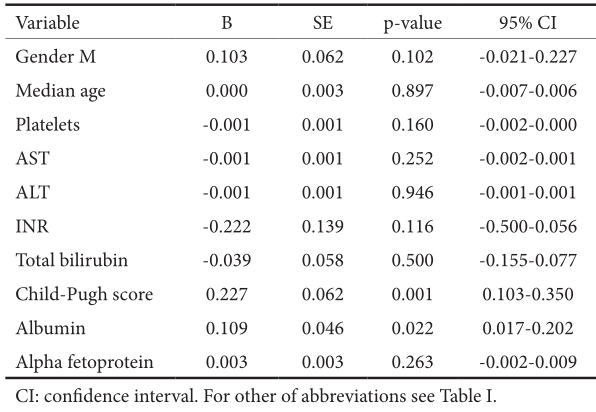
结果:我们的队列包括53%的男性,中位年龄为60岁(27÷77);47%为ombitasvir/paritaprevir/ritonavir+dasabuvir±利巴韦林,40%为ledipasvir/SOF, 13%为elbasvir/ grazoprevir。42%的患者伴发并发症,45%有代偿性肝硬化,2%有肝细胞癌(HCC)治疗,1%有乙型肝炎病毒合并感染。按治疗意向划分的SVR在139/143中(97.2%),在141/143中(98.6%)。未发现SVR的预测因素。肝硬化患者的肝功能失代偿率为6%,在多因素分析中与Child-Pugh评分(p<0.01)和严重脂肪变性(p=0.004)有统计学相关性。在所有肝硬化患者中,3.6%报告了新的HCC的发生,并与肝功能不良相关[较高的Child-Pugh评分(p=0.001)和低白蛋白水平(p=0.02)]。与治疗相关的严重不良事件发生率为1/143(0.7%)。
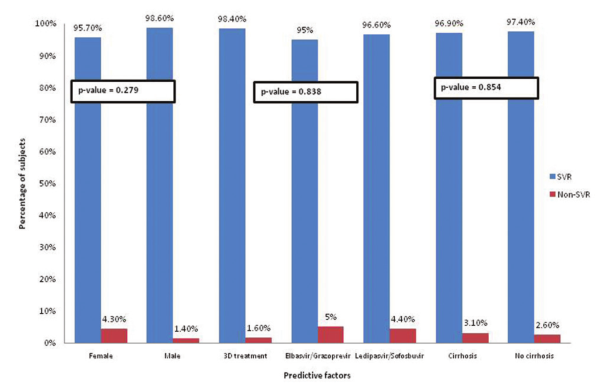
图1所示。SOF/VEL/VOX的可能预测因素
表1 肝硬化患者治疗结束后12周肝功能失代偿的预测因素(双变量分析)
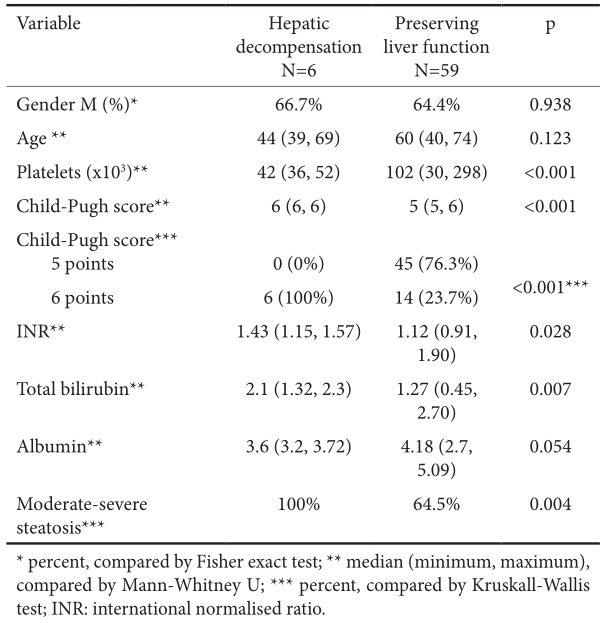
表2 肝硬化患者治疗结束后12周肝功能失代偿的预测因素(多元回归分析)
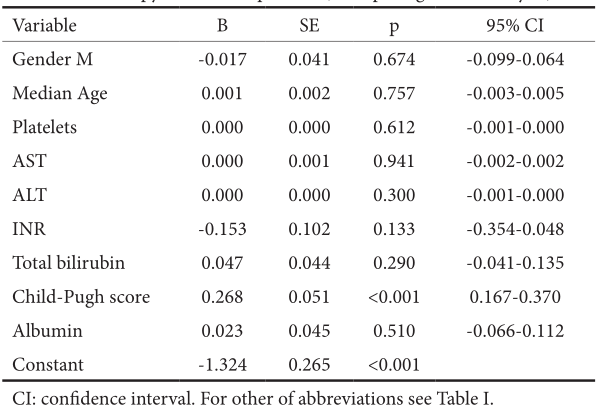
表4 肝硬化患者治疗后12周发生HCC的预测因素(多元回归分析)
结论:SOF/VEL/VOX在我们的患者群体中高效,SVR为97.2%。在SVR中,6%的肝硬化患者发生肝功能失代偿,与肝功能障碍有关。
原文出处:Gheorghe L, Preda C, Trifan A, et al.Real World Efficacy and Safety of Sofosbuvir + Velpatasvir + Voxilaprevir in Romanian Patients with Genotype 1b HCV Infection Non-reponders to DAAs Therapy.J Gastrointestin Liver Dis 2022 Dec 17;31(4)


