头条新闻!《Phytomedicine》揭示凉膈散如何通过抑制α7nAChR介导的线粒体自噬,预防病毒性急性肺损伤
时间:2024-11-23 16:01:16 热度:37.1℃ 作者:网络
病毒性肺炎是一种急性呼吸道感染,其病原体包括冠状病毒、流感病毒、腺病毒以及呼吸道合胞病毒等多种呼吸道病毒。重症患者,特别是患有严重COVID-19或甲型流感的个体,可能会遭受包括急性肺损伤(ALI)、急性呼吸窘迫综合征(ARDS)在内的严重并发症,以及肺外器官的损伤,这些情况可能会最终导致患者死亡。目前,治疗ALI/ARDS的主要临床手段包括机械通气、体外膜氧合和糖皮质激素,然而这些方法存在高昂的成本和较高的并发症风险。因此,目前尚缺乏一种令人满意的治疗方法。
凉膈散(LGS)是源自中医传统方剂的著名药方。该方属于清热剂,具有清热解毒、泻火解毒以及清上泄下之功效。它主要用于治疗上中焦邪气郁结而引发的热症。现代研究显示,LGS通过调节细胞因子风暴发挥抗ALI的作用,并能通过抑制GSK3β的磷酸化和p-JNK的表达来抑制脂多糖诱导的斑马鱼和细胞的急性炎症反应。同时,LGS的最佳配方成分亦通过抑制MyD88/NF-κB和MAPK通路来抑制过度的炎症反应。
近日,一篇名为“Liang–Ge–San protects against viral infection-induced acute lung injury through inhibiting α7nAChR-mediated mitophagy”的文章探讨了LGS对病毒感染引起的ALI的影响及其作用机制。

图1 论文首页
研究方法
该研究通过定量逆转录聚合酶链反应(qRT-PCR)和酶联免疫吸附测定(ELISA)评估了LGS对体外病毒诱导的炎症反应的抑制效果。并且通过蛋白质印迹法(Western blot)检测α7型烟碱型乙酰胆碱受体(α7nAChR)的蛋白表达水平。利用小干扰RNA(siRNA)或α7nAChR特异性抑制剂甲基莲心碱(MLA)来抑制α7nAChR的活性,进而研究其在LGS抗炎作用中的功能。
同时,研究还构建了巨噬细胞RAW264.7与肺泡上皮细胞MLE-12的共培养模型,以模拟这两种细胞间的相互作用。此外,研究通过蛋白质印迹法、免疫荧光技术、流式细胞术以及透射电子显微镜技术,对LGS在抑制线粒体自噬方面的作用进行了检测。在体内实验中,建立了由严重急性呼吸综合征冠状病毒2型(SARS-CoV-2)、甲型流感病毒H1N1或聚肌苷酸:聚胞苷酸(Poly(I:C))感染引发的ALI小鼠模型,以探究LGS的治疗效果及其作用机制。
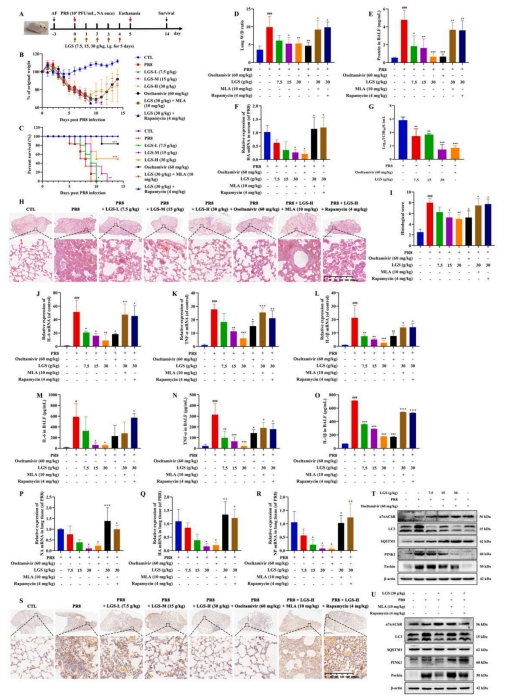
图2 LGS对BALB/c小鼠鼻内感染H1N1诱导的ALI有治疗作用
研究结果
结果显示,LGS在减少病毒感染的RAW264.7细胞中,降低了IL-6、TNF-α和IL-1β的释放,并提升了α7nAChR的表达水平,而α7nAChR的阻断作用消除了LGS的抗炎效果。进一步的研究表明,LGS显著抑制了Poly(I:C)在MLE-12细胞中引发的自噬现象,以及在RAW264.7和MLE-12细胞共培养系统中的自噬活动,这一抑制作用可能与减少IL-6、TNF-α和IL-1β的分泌有关。在进一步深入的研究中揭示了,LGS通过抑制MLE-12细胞中ROS的生成,抑制了由TNF-α诱导的线粒体损伤和线粒体自噬。体内实验结果显示,LGS显著延长了由SARS-CoV-2、H1N1或Poly(I:C)感染引起的ALI小鼠的生存时间,并减轻了病理损伤和急性炎症,这与抑制α7nAChR介导的线粒体自噬密切相关。
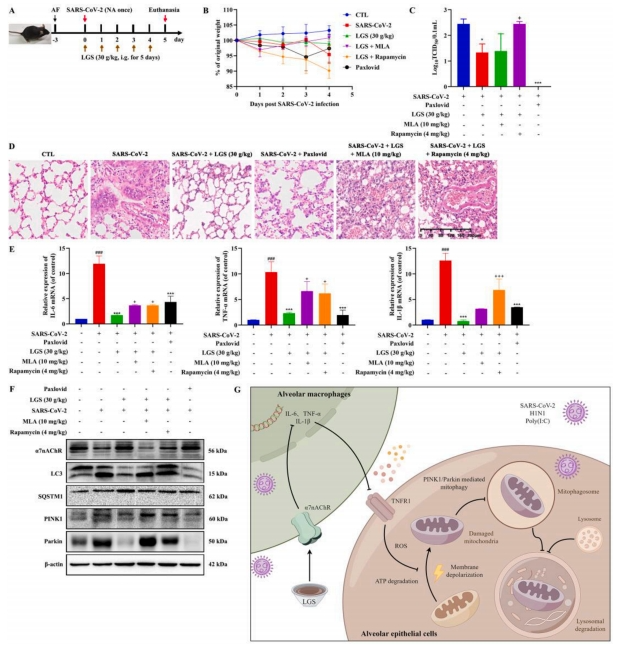
图3 LGS对hACE2 C57BL/6小鼠鼻内感染SARS-CoV-2诱导的ALI均有治疗作用
结论
总之,研究表明,LGS通过促进α7nAChR的表达,展现了抗SARS-CoV-2和H1N1病毒的活性,进而抑制了由细胞因子引发的MLE-12细胞线粒体吞噬现象,减轻了ALI。这些研究结果暗示,LGS有潜力成为治疗由病毒感染引起的ALI/ARDS的潜在药物。同时,α7nAChR和自噬过程可能在病毒感染导致的ALI/ARDS中扮演着至关重要的角色。
参考文献:
Yu J, Lu Z, Chen B, He X, Zhao W, Cao H, Li Y, Peng G, Ou J, Ma Q, Yu L, Liu J. Liang-Ge-San protects against viral infection-induced acute lung injury through inhibiting α7nAChR-mediated mitophagy. Phytomedicine. 2024 Nov 10;135:156231. doi: 10.1016/j.phymed.2024.156231


