NEJM:Axatilimab治疗复发或难治性慢性GVHD的II期研究结果
时间:2024-09-23 06:01:16 热度:37.1℃ 作者:网络
慢性移植物抗宿主病(GVHD)是异基因造血干细胞移植的主要长期并发症,发生率为30%~70%,患者可能具有标志性的纤维化特征,如硬皮病和肺纤维化,对经典的免疫抑制剂通常难治。cGVHD主要病理生理过程为免疫炎症反应,常见和特征性的病理改变是纤维化。基于基础和临床研究,将cGVHD的发生分为三个阶段:组织损伤引起的早期炎症(第一阶段),慢性炎症引起的胸腺损伤及B细胞和T细胞免疫失调(第二阶段),最终导致组织纤维化(第三阶段)。cGVHD的三个阶段通常是连续性事件,但是第一阶段的患者也可以同时进入第二和第三阶段,三个阶段可共同致病。
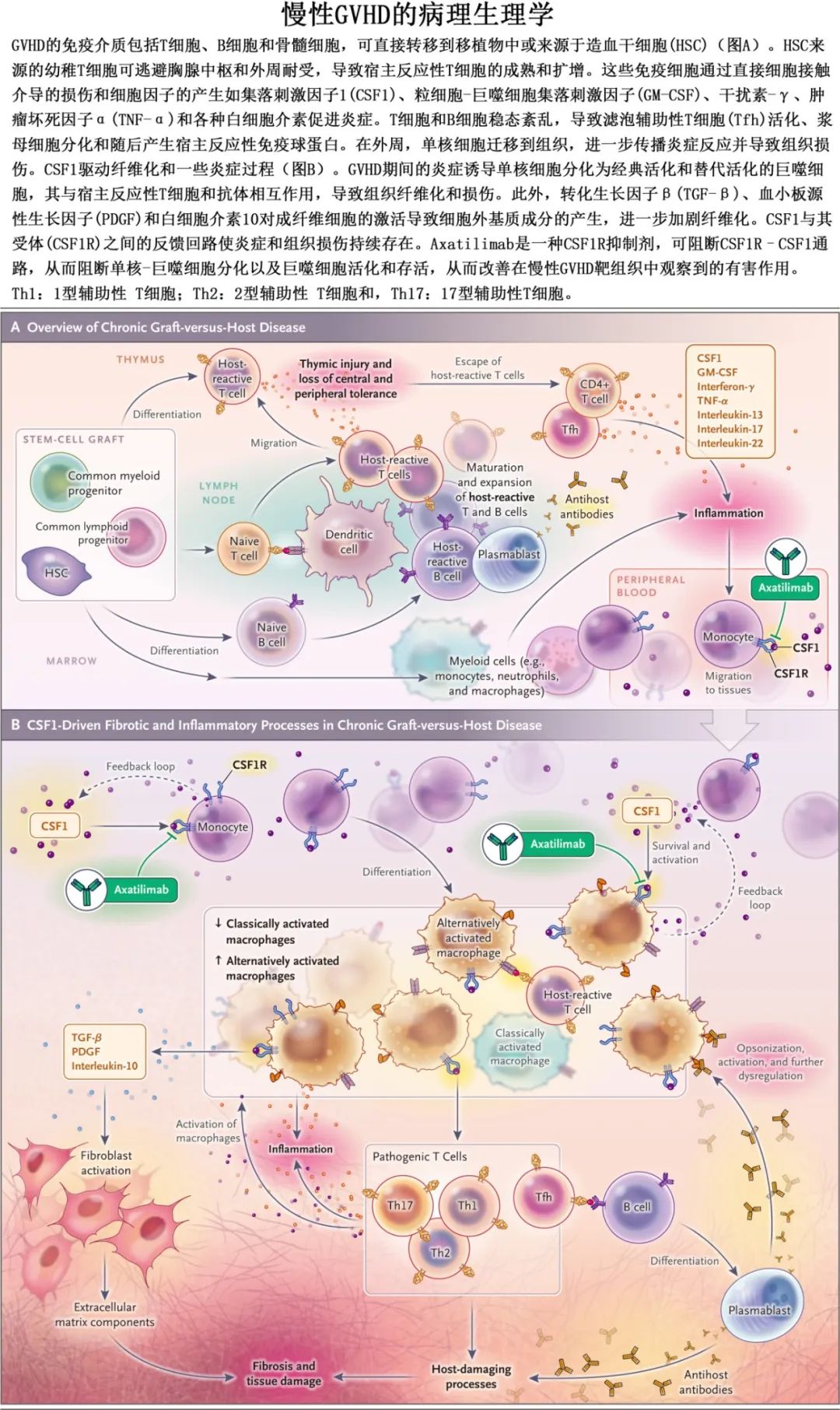
目前一线治疗药物为糖皮质激素,美国FDA还批准了三种药物(伊布替尼、芦可替尼和贝舒地尔),但它们并非总是有效。集落刺激因子1受体(CSF1R)依赖性单核细胞和巨噬细胞是慢性GVHD的关键介质,CSF1R阻断抗体axatilimab在慢性GVHD中显示出良好的临床活性。
2024年8月14日,美国FDA批准axatilimab治疗既往至少2线全身治疗失败的体重≥40kg的成人和儿童慢性移植物抗宿主病(cGVHD)患者,此外,中国国家药监局药品审评中心(CDE)官网2024年6月27日公示,axatilimab获批开展临床试验。
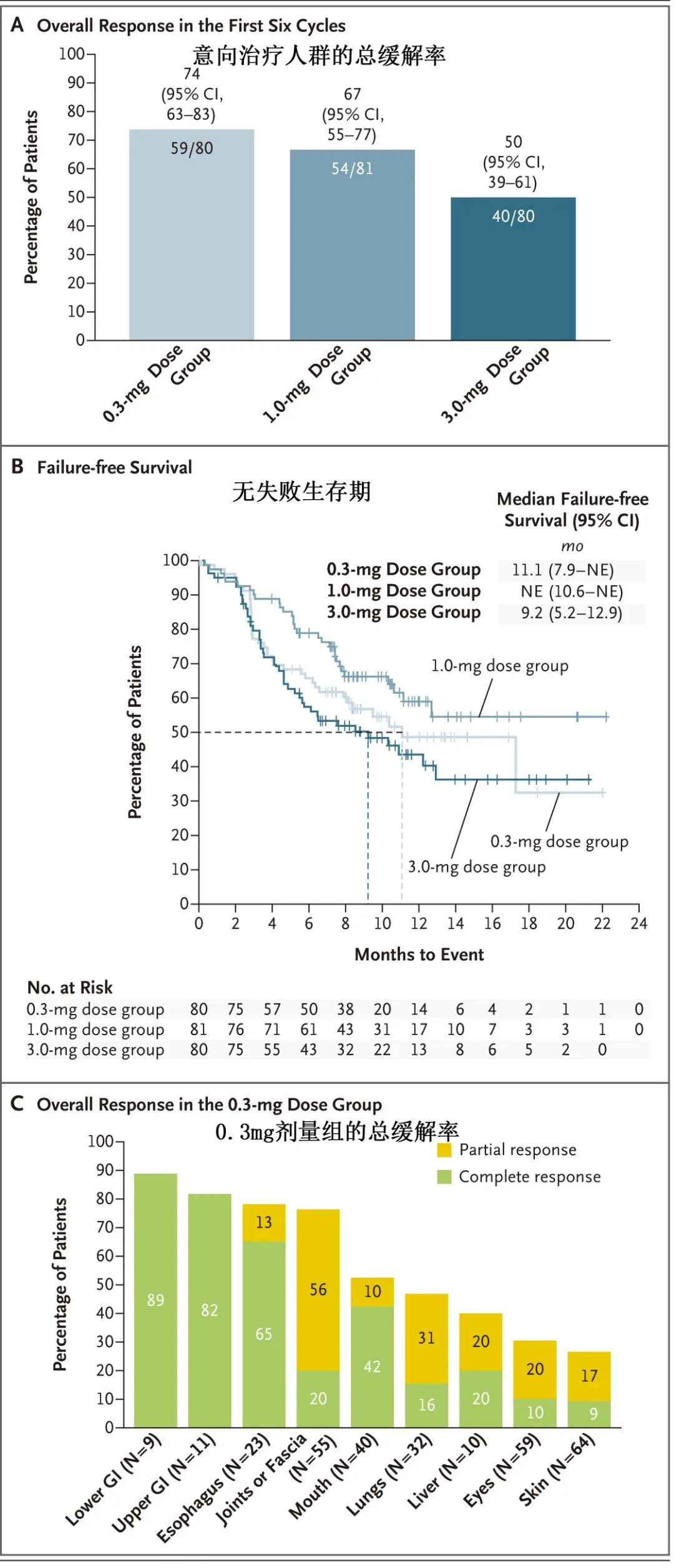
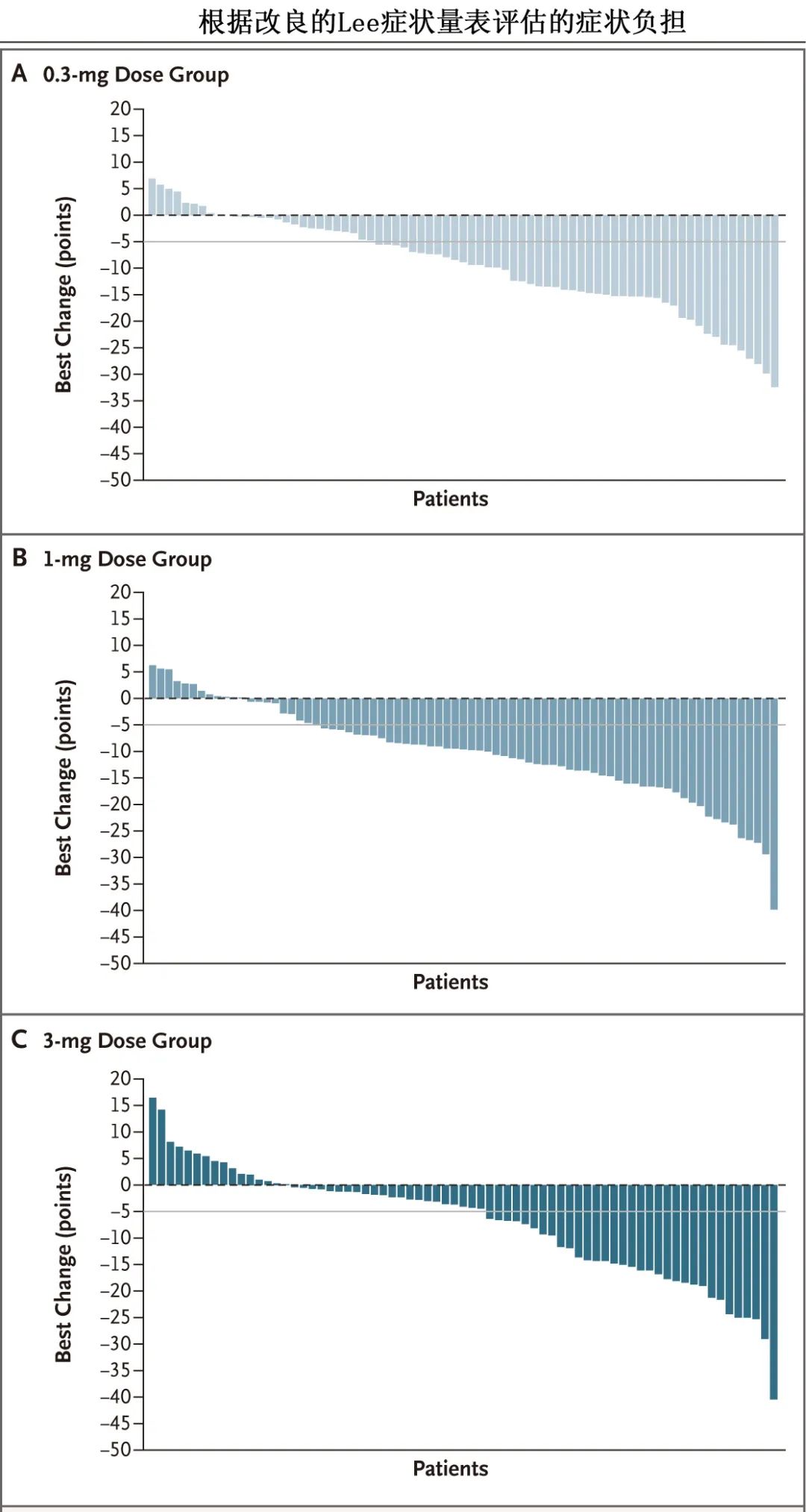
Axatilimab的获批是基于一项跨国、关键、随机2期研究,该研究评估了其三种不同剂量治疗复发或难治性慢性GVHD。患者随机分配接受静脉给药,剂量包括:每2周给予0.3mg/Kg (0.3mg剂量组)、每2周给予1mg/Kg (1mg剂量组)、每4周给予3mg/Kg (3mg剂量组)。主要终点为前6个周期的总缓解率(完全缓解或部分缓解),关键次要终点为患者报告的慢性GVHD症状负担减轻,其通过修改后的Lee症状量表(范围从0到100,分数越高表明症状越差)减轻5分以上来评估。
研究共纳入241例患者(0.3mg剂量组80例,1mg剂量组81例,3mg剂量组80例)。所有组均达到主要终点;0.3 mg剂量组有74%的患者获得总缓解,1 mg剂量组有67%,3mg剂量组有50%;分别有60%、69%和41%的患者显示改良的Lee症状量表降低5分以上。此外三组均快速缓解,至缓解时间均少于2个月,且12个月持续缓解率高于50%;达到有临床意义的症状减轻的中位时间分别为1.7个月、1.1个月和1.1个月,与三组至总缓解的中位时间相似。中位无失败生存期为11.1个月(剂量递增视为失败事件),三组的12个月无失败生存率分别为49%、59%和44%。所有剂量组的所有器官中都观察到器官特异性缓解,包括纤维化变化最多的器官。
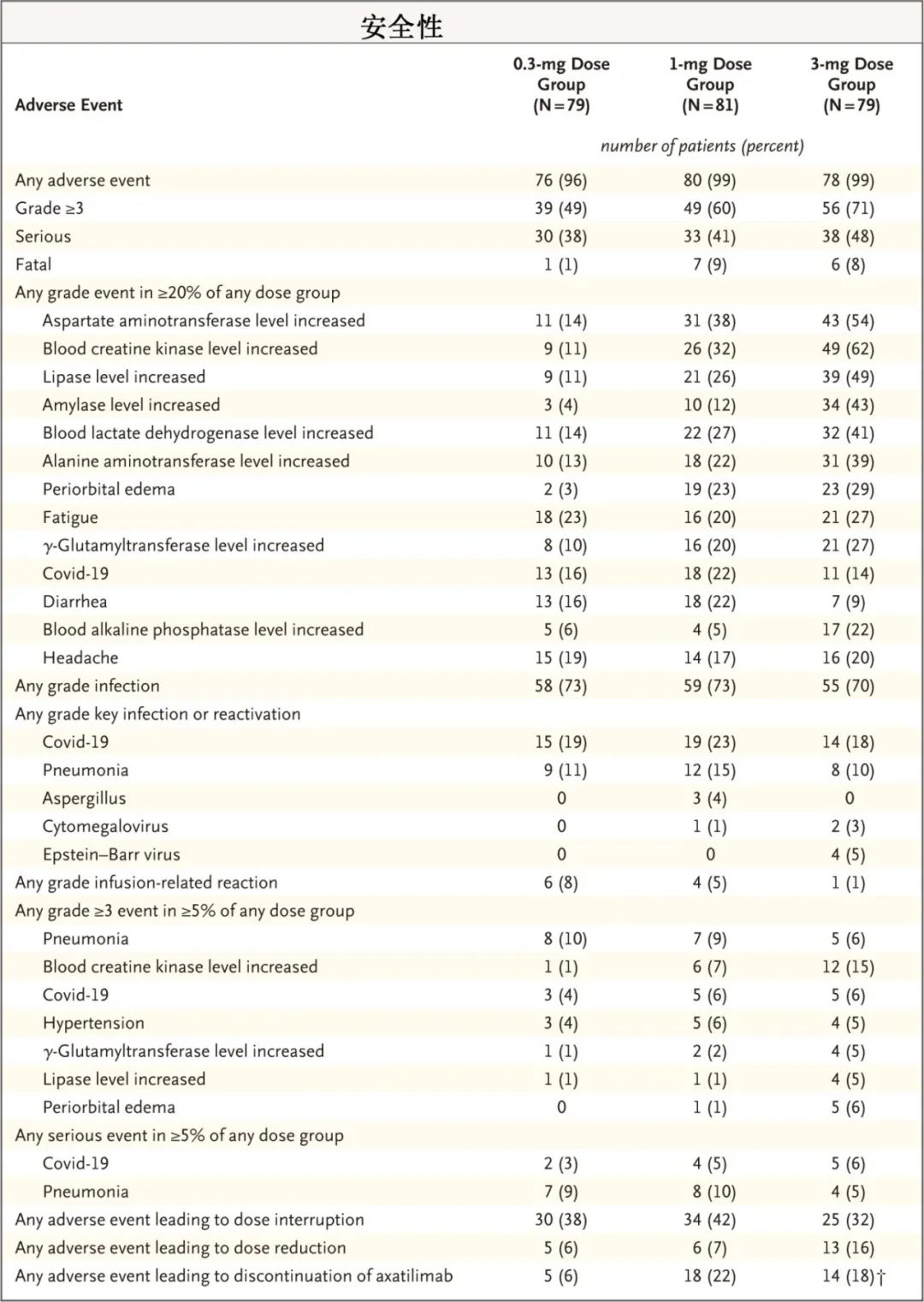
安全性方面,最常见的不良事件为与CSF1R阻断相关的剂量依赖性瞬时实验室异常,且随着剂量的增加,发生率和级别也在增加。三剂量组输注反应分别为8%、5%和1%;感染分别为73%、73%和70%;≥3级不良事件分别为49%、60%和71%。导致Axatilimab停药的不良事件,在0.3mg剂量组中占6%,在1mg剂量组中占22%,在3mg剂量组中占18%。
该研究证实Axatilimab治疗复发或难治性慢性GVHD患者的缓解率很高(50%-74%),包括标准治疗失败的患者。对于糖皮质激素和FDA批准的三个其他慢性GVHD药物(伊布替尼、芦可替尼和贝舒地尔),Axatilimab是新的有希望的药物。由于Axatilimab的机制与FDA批准的现有药物并不重叠,因此联合方案也值得探索。此外也可以探索Axatilimab在慢性GVHD早期或预防慢性GVHD方面的疗效。
参考文献
1.Wolff D,et al.Axatilimab in Recurrent or Refractory Chronic Graft-versus-Host Disease.N Engl J Med . 2024 Sep 19;391(11):1002-1014. doi: 10.1056/NEJMoa2401537.
2.Mohty M.CSF1R Blockade for Refractory Chronic Graft-versus-Host Disease.N Engl J Med . 2024 Sep 19;391(11):1055-1059. doi: 10.1056/NEJMe2407369.
3.Sarantopoulos S.Targeting CSF1R in Chronic GVHD — Lessons in Translation.N Engl J Med . 2024 Sep 19;391(11):1053-1055. doi: 10.1056/NEJMe2407731.
4. 中华血液学杂志, 2021,42(4) : 265-275.


