Cell:新型AAV变体,高效靶向T细胞,加速基因工程T细胞疗法开发
时间:2023-01-16 15:01:47 热度:37.1℃ 作者:网络
近年来,基于基因工程改造的CAR-T细胞疗法在治疗血液类癌方面展现了强大疗效,FDA先后批准了6款CAR-T疗法上市,研究人员也在积极探索CAR-T治疗实体瘤的潜力。
在构建CAR-T细胞的过程中,通常使用逆转录病毒或慢病毒载体,但是这两类病毒载体会随机整合到细胞基因组中,这种随机整合可能导致T细胞功能异质性、转入基因沉默,甚至可能激活细胞癌变,这限制了细胞治疗产品的有效性和安全性。
近年来,随着CRISPR基因编辑技术的进步,我们已经可以实现在原代人T细胞中的特定位点精确整合目标基因,这拓宽了基础研究和临床应用中的T细胞工程改造的范围。
腺相关病毒(AAV)在是当前应用最广泛的体内基因治疗递送载体,相比逆转录病毒或慢病毒,AAV通常不会整合到基因组中。因此可作为T细胞基因工程改造的更安全的递送载体,然而,迄今为止,还没有一种AAV血清型能够高效转导T细胞。
近日,加州大学旧金山分校和杜克大学医学院的研究人员在 Cell 期刊发表了题为:An evolved AAV variant enables efficient genetic engineering of murine T cells 的研究论文。
该研究在AAV6的基础上进化出了一种能够高效转导小鼠T细胞的AAV变体Ark313,并通过CRISPR全基因组筛选确定了QA2是Ark313高效转导的重要因素。Ark313能够实现向小鼠T细胞的高效转基因递送和大片段DNA的有效精确靶向整合,可用于构建更安全更精确的CAR-T和TCR-T细胞。

利用同源定向修复(HDR)将大片段DNA精确靶向并插入到T细胞,已经成为T细胞疗法的变革性手段。使用腺相关病毒(AAV)来递送大片段DNA模板,大大提高了基因插入的效率,但目前仍然缺少一种高效转导T细胞的AAV血清型。
为了实现在小鼠T细胞中的靶向基因敲入,研究团队构建了一基于在AAV6型(AAV6)的AAV衣壳库,在此基础上改造进化出了新的AAV血清型——Ark313,其在小鼠T细胞中表现出高转导效率。研究团队还通过基于CRISPR的全基因组敲除筛选,确定小鼠QA淋巴细胞抗原2(QA2)是Ark313能够高效感染的重要因素。
接下来,研究团队证明了Ark313可实现对小鼠T细胞高效的不整合的DNA递送、CRISPR-Cas9介导的基因敲除,以及大片段DNA的定向整合。
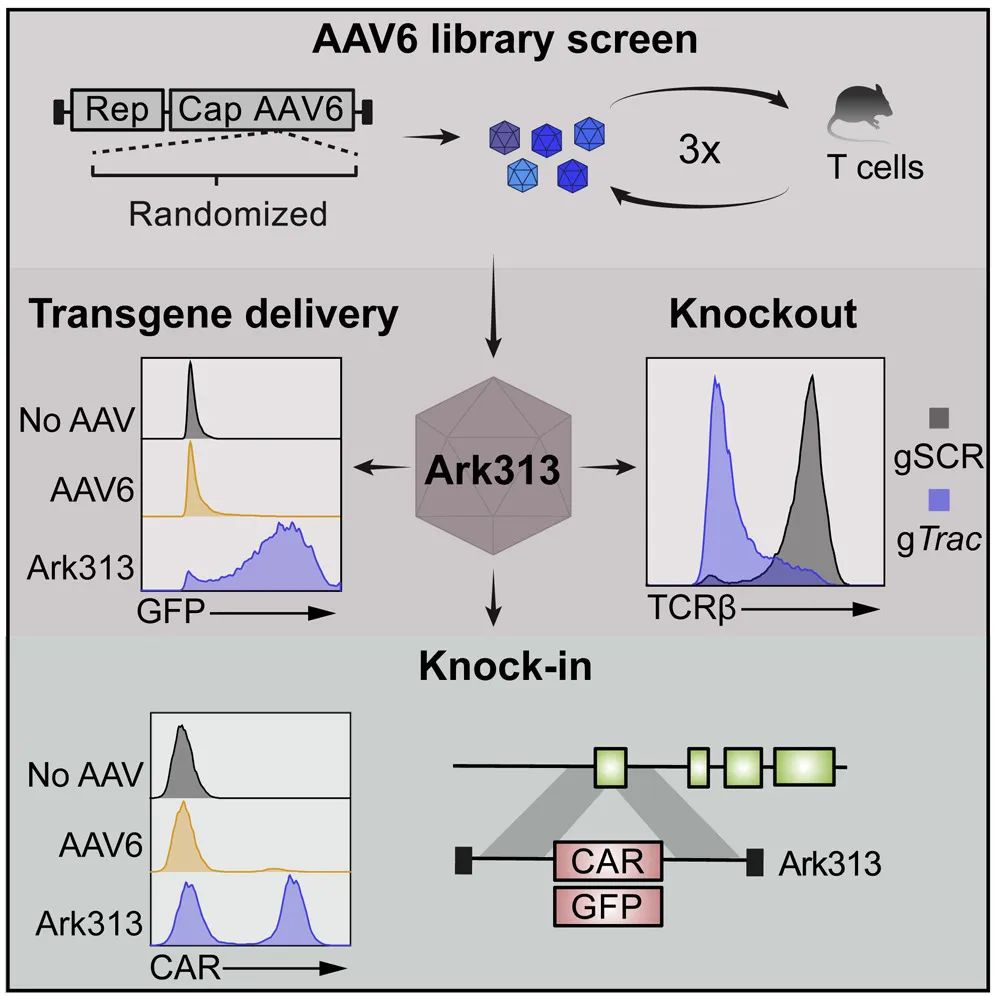
更重要的是,Ark313能够用于构建TRAC靶向的CAR-T细胞和转基因的TCR-T细胞。这一高效的靶向小鼠T细胞的腺相关病毒血清型为改进T细胞疗法提供了巨大潜力,也为T细胞免疫学研究开辟了新的道路。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(22)01535-5


